引言
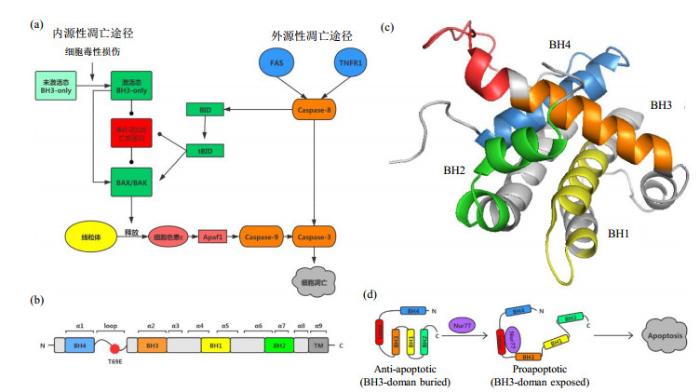
细胞凋亡是细胞自主执行程序化死亡的过程,对于多细胞生物维持正常生长发育和内环境的稳态至关重要.细胞凋亡的功能异常会导致一些疾病的发生.在哺乳动物中,细胞凋亡存在外源性和内源性两种途径[1, 2],如图 1(a)所示.其中,外源性途径通过细胞表面死亡受体TNFR1与胞外死亡配体FAS的结合激活Caspase-8,并进一步激活下游的Caspase蛋白从而促发细胞凋亡[3].内源性途径又称为线粒体介导的凋亡途径[4],主要由Bcl-2家族蛋白调控.Bcl-2家族蛋白可分为促凋亡蛋白和抗凋亡蛋白两类.当细胞受到各种毒性损伤时,如病毒感染、DNA损伤和生长激素的匮乏[5]等,大量促凋亡BH3-only蛋白被激活,进而促进促凋亡蛋白BAX和BAK形成同源寡聚体,促使线粒体外膜发生通透化,导致细胞色素c的释放,进一步促进Apaf1的寡聚化从而激活Caspase蛋白引发细胞凋亡[6, 7]. Bcl-2是凋亡途径中行使抑制凋亡功能的重要蛋白,其功能受翻译后修饰调控,如磷酸化修饰.它含有9个α-螺旋,由四个BH同源基序(BH1、BH2、BH3、BH4)、一段无序的loop区和一个跨膜区(TM)组成[8],如图 1(b)所示.由于BH4和BH3基序之间存在柔性loop区,全长的Bcl-2膜蛋白在溶液中的溶解性不佳,至今尚未见全长蛋白结构表征的报道.为了解决蛋白质的可溶性问题,Petros等[9]用Bcl-xl的一部分loop区(35~50)替换Bcl-2的整个loop区并删除跨膜区,从而设计了一种嵌合体蛋白Bcl-2/xl,并解析了其三维结构,如图 1(c)所示.
图1
图1
Bcl-2信号转导通路及其结构分区.(a)细胞凋亡的两种途径[8];(b) Bcl-2的结构分区示意图[8];(c) Bcl-2/xl嵌合体在溶液中的结构[9](PDB:1G5O),四个BH结构域的颜色与(b)的颜色相对应,红色为Bcl-xl的loop区;(d) Bcl-2-Nur77凋亡信号通路[12]
Fig.1
The signal transduction pathways and the structure of Bcl-2. (a) The two types of apoptosis[8]; (b) The schematic diagram of Bcl-2 structure[8]; (c) The solution structure of Bcl-2/xl, (PDB: 1G5O)[9]. The colors of the four BH motifs correspond to (b), in which the loop of Bcl-xl is shown in red; (d) The signal transduction pathway of Bcl-2-Nur77[12]
核孤儿受体Nur77位于细胞核中,据文献[10]报道,Nur77可出核定位至线粒体上与Bcl-2发生相互作用,使其功能发生逆转,由细胞保护者变为细胞杀手,诱发线粒体释放细胞色素c,促使细胞凋亡.因此,由Nur77和Bcl-2介导的信号转导通路是癌症细胞靶向凋亡的重要药物靶标.Bcl-2的loop区基因的缺失和Nur77的LBD结构域(Ligand Binding Domain)基因的缺失会导致细胞内的Bcl-2无法与Nur77相互作用,进而无法诱发细胞色素c的释放[11].Kolluri等[12]进一步研究推测,Bcl-2的loop区与Nur77的LBD结构域的结合使Bcl-2的构象发生改变,暴露出BH3结构域,从而行使促凋亡功能,如图 1(d)所示.由于蛋白体系大溶解性差等因素,至今未有Bcl-2与Nur77在原子水平上相互作用的相关研究被报道.
然而Bcl-2蛋白的功能受翻译后磷酸化修饰调控,其磷酸化位点位于BH4和BH3之间的loop区,包括T56、T69、S70、T74和S87[13-15],其中T69、S70、S87是最常见的磷酸化位点,特别是T69,如图 1(b)所示.Bcl-2的磷酸化修饰对细胞凋亡的影响仍存在许多争议,例如将S70、S87、T69位的氨基酸突变成丙氨酸后,经生理死亡信号刺激和紫杉醇处理后,Bcl-2表现出更强的抗凋亡活性[16, 17],表明Bcl-2的磷酸化减弱了其抗凋亡功能.与之相反的是,其它研究将S70、S87、T69位点突变成谷氨酸模拟磷酸化后,增加了其抗凋亡的功能[18, 19].Bcl-2磷酸化后的功能差异可能与所处的细胞环境相关[20],其磷酸化修饰对Bcl-2与Nur77相互作用的影响目前并不清楚.
为了在原子水平上针对Bcl-2与Nur77的相互作用以及T69磷酸化修饰对其相互作用的影响进行研究,我们构建了含有loop区的野生型胞内全长Bcl-2(1~218 of Bcl-2,wtBcl-2)及其T69E模拟磷酸化的突变体,以及只含结构区的Bcl-2/xl嵌合体,综合运用圆二色谱(CD)、免疫印迹(Western Blot)、核磁共振(NMR)等实验技术对其结构和与Nur77 LBD结构域相互作用的功能进行研究.我们探索了loop区缺失对Bcl-2与Nur77相互作用的影响,并对比了wtBcl-2和T69E突变体与Nur77 LBD结构域的亲和力,探讨了T69磷酸化修饰对Bcl-2与Nur77相互作用的影响.我们的实验结果将对后续针对Bcl-2和Nur77信号转导通路的研究提供参考.
1 实验部分
1.1 蛋白样品的表达与纯化
1.1.1 蛋白样品的表达
(1)Bcl-2/xl嵌合体、wtBcl-2及其T69E突变体的表达:
Bcl-2/xl嵌合体和wtBcl-2由上海生工公司构建合成,T69E突变体由本实验室构建.
将Bcl-2/xl嵌合体、wtBcl-2及其T69E突变体的质粒转化至大肠杆菌BL21(DE3),并于LB培养基中37 ℃培养12 h,然后接种至15N标记氯化铵的M9培养基中,37 ℃培养至OD600达到0.6~0.8后,加入终浓度为0.5 mmol/L的异丙基硫代半乳糖苷(IPTG),于20 ℃诱导表达20 h,6 000 rpm离心10 min后弃上清,收集沉淀,放入−20 ℃冰箱保存待用.
对于非标记样品,直接用LB培养基表达,表达条件与标记蛋白一致.
(2)Nur77 LBD结构域的表达:
将野生型Nur77 LBD(wtNur77)的质粒(厦门大学张晓坤教授提供)转化到大肠杆菌BL21(DE3),并于LB培养基中37 ℃过夜培养,然后接种至15N标记氯化铵的M9培养基中,37 ℃培养至OD600达到0.6~0.8,加入终浓度为0.5 mmol/L的IPTG,于20 ℃诱导表达16~20 h,6 000 rpm离心15 min后去上清,收集沉淀,放入−20 ℃冰箱保存待用.
对于非标记样品,直接用LB培养基表达,表达条件与标记蛋白一致.
1.1.2 蛋白样品的纯化
(1)Bcl-2/xl嵌合体的纯化:
蛋白纯化所用层析柱均购自GE Healthcare公司.将菌液用高压破碎仪裂解后,20 000 rpm离心30 min后留取上清.蛋白初步纯化采用Ni亲和柱(其中缓冲液Buffer A含有20 mmol/L NaH2PO4、2 mol/L NaCl、20 mmol/L咪唑;Buffer B含有20 mmol/L NaH2PO4、2 mol/L NaCl、500 mmol/L咪唑,pH=8.0).上样完成,并待Buffer A洗平后,用15% Buffer B除去大部分杂蛋白;再用50% Buffer B将目标蛋白洗脱下来,并浓缩样品体积至5 mL以内;最后用脱盐柱对蛋白进行纯化以去除盐离子(缓冲液为无菌双蒸水).分装蛋白并冻干备用.
(2)wtBcl-2及其T69E突变体的纯化[21]:
取65 mL Buffer A(含50 mmol/L Tris、50 mmol/L NaCl,pH=8.0)悬浮菌体并使用高压破碎仪裂菌,20 000 rpm离心40 min后留取沉淀.取40 mL Buffer B(含7 mol/L尿素、20 mmol/L Tris、200 mmol/L NaCl、0.06%月桂酰肌氨酸钠、10%甘油,pH=8.0)溶解沉淀,超声破碎25 min后,20 000 rpm离心30 min留取上清.然后将上清液置于5 L Buffer C [含20 mmol/L Tris、200 mmol/L NaCl、2 mmol/L二硫苏糖醇(DTT)、0.2%月桂酰肌氨酸钠(SAR)、10%甘油,pH=7.8]中于4 ℃过夜透析.蛋白初步纯化采用Ni亲和柱(缓冲液Buffer D含20 mmol/L Tris、200 mmol/L NaCl、20 mmol/L咪唑、0.05% SAR、10%甘油;Buffer E含20 mmol/L Tris、200 mmol/L NaCl、500 mmol/L咪唑、0.05% SAR、10%甘油,pH=7.8).透析后的样品经7 000 rpm离心5 min后取上清过滤,上样完成,待Buffer D洗平后,用Buffer E从0%到50%进行梯度洗脱,收集目标蛋白[根据十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行判断]并浓缩样品至体积在5 mL以内;蛋白进一步纯化用Superdex 200 pg(缓冲液Buffer F为20 mmol/L NaPi、50 mmol/L NaCl、2 mmol/L DTT、0.05% SAR,pH=7.4),收集目标蛋白并浓缩样品体积至10 mL以内.分装蛋白后不冻干直接放入−80 ℃冰箱备用.
(3)Nur77 LBD结构域的纯化:
将菌液用高压破碎仪裂解后,20 000 rpm离心30 min后留取上清.蛋白初步纯化采用Ni亲和柱(缓冲液Buffer A含20 mmol/L Tris、300 mmol/L NaCl、10%甘油、0.005%巯基乙醇;Buffer B含20 mmol/L Tris、300 mmol/L NaCl、10%甘油、0.005%巯基乙醇、1 mol/L咪唑.pH=8.0).上样完成,待Buffer A洗平后,用Buffer B从0%到50%进行梯度洗脱,合并目标蛋白(根据SDS-PAGE进行判断)并浓缩样品将其置换到低盐Buffer C中;蛋白进一步用DEAE弱阴离子交换柱纯化(缓冲液Buffer C含20 mmol/L Tris、5 mmol/L DTT;Buffer D含20 mmol/L Tris、5 mmol/L DTT、2 mol/L NaCl.pH=8.0),合并目标蛋白并浓缩样品将蛋白转移至Buffer E(含20 mmol/L Tris,pH=8.0)中,分装蛋白并冻干备用.
1.2 Western Blot实验
将纯化后的wtBcl-2蛋白样品浓度用Buffer F稀释至0.05 mmol/L左右,用SDS-PAGE将样品分开,用半干转模仪将蛋白质从电泳后的聚丙烯酰胺凝胶上转印至硝酸纤维素(NC)膜上,然后用含有5%脱脂奶粉的TBST溶液封闭膜1.5~2 h.用His-tag抗体(小鼠单抗)25 ℃孵育2 h后,用TBST洗膜5次,每次5 min.继续用二抗(羊抗鼠)25 ℃孵育2 h后洗膜5次.最后将显色液均匀滴在膜上(整个过程注意避光)用成像仪显色.
1.3 CD实验
wtBcl-2样品用Buffer F稀释浓度至20 μmol/L,体积1 mL左右.在24 ℃条件下采集CD谱.实验操作中用1 mm光径样品石英皿进行远紫外CD测试,在180~260 nm范围内,以60 nm/min的速度记录3次取平均值.用Origin 8.0进行CD谱的统计学分析,以波长为横坐标,摩尔椭圆度为纵坐标,作出曲线.
1.4 15N-1H TROSY实验
15N-1H TROSY实验于Bruker Avance 800 MHz NMR谱仪上完成.将冻干的Nur77蛋白样品溶于含有20 mmol/L Tris、2% DMSO、10% D2O的缓冲液中,pH调为8.0,蛋白质终浓度为0.2~0.5 mmol/L. 向未冻干的Bcl-2蛋白(溶于20 mmol/L NaPi、50 mmol/L NaCl、2 mmol/L DTT、0.05% SAR,pH=7.4)、复溶后的Bcl-2/xl蛋白(复溶液与上述Bcl-2蛋白的Buffer一致)加入10% D2O,蛋白终浓度为0.15~0.3 mmol/L,pH调为7.4.
实验温度均设为298 K.实验参数为:F2(1H)和F1(15N)维谱宽分别设为9 615.385 Hz和2 189.516 Hz,采样数据点阵t2×t1 = 2 048×200,累加次数ns = 16,弛豫等待时间d1 = 1.0 s.
1.5 解离常数KD
其中,
解离常数
其中
2 结果与讨论
2.1 变复性获得可溶性wtBcl-2
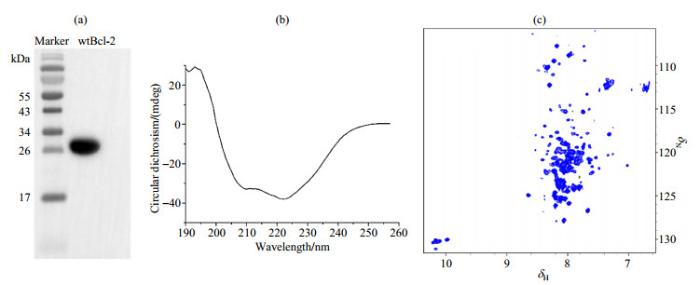
Bcl-2在原子水平上的相关研究受限于其全长蛋白的可溶性.由于截去TM结构域的wtBcl-2疏水性仍较强,在上清中的表达量极少,大部分表达在包涵体中,所以我们采取包涵体变复性的方式来纯化wtBcl-2.蛋白复性是一个十分复杂的过程,受温度、溶液pH、蛋白浓度等许多因素的影响.经过大量的条件优化,我们成功地复性了wtBcl-2,并获得高纯度的可溶性样品.我们利用Western Blot证实复性得到的蛋白质样品确为含有His-tag标签的目的蛋白wtBcl-2,如图 2(a)所示;并利用CD谱检测蛋白质的二级结构,如图 2(b)所示,与嵌合体Bcl-2/xl的60.2% α-螺旋含量相比,复性后的wtBcl-2蛋白具有24.3%的α-螺旋结构.为了得到原子水平分辨率的相关信息,我们运用NMR采集了wtBcl-2的二维15N-1H TROSY谱图,如图 2(c)所示,蛋白质谱峰信号相对分散,谱峰中同时包含无序区域和有结构区的部分信号,但是结构区的信号消失程度较大,说明蛋白在溶液环境中具有较为复杂构象交换,但是仍可以提供丰富的相互作用信息.因此,我们运用变复性的方法获得了可以在原子水平上研究其结构和功能的wtBcl-2蛋白样品.
图2
图2
野生型胞内全长Bcl-2(wtBcl-2)蛋白的纯化和验证.(a)免疫印迹法检测wtBcl-2蛋白的表达纯化;(b)圆二色谱检测wtBcl-2蛋白的二级结构;(c) 15N标记的0.2 mmol/L wtBcl-2的15N-1H TROSY谱图
Fig.2
The purification and validation of wild type full-length Bcl-2 (wtBcl-2). (a) The purified wtBcl-2 validated by Western blot; (b) The secondary structure of the purified wtBcl-2 detected by using CD spectrum; (c) 15N-1H TROSY spectrum of 15N-labeled 0.2 mmol/L wtBcl-2
2.2 可溶性wtBcl-2的活性验证
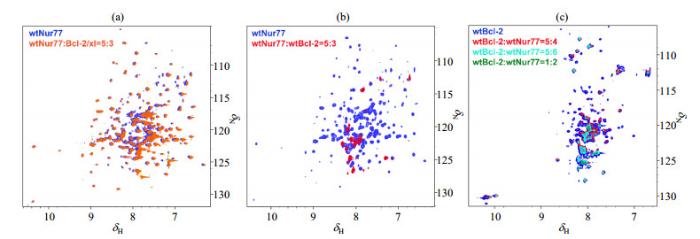
据文献[12]报道,Bcl-2能够与Nur77 LBD结构域发生相互作用.为了验证变复性后的wtBcl-2蛋白是否具有与Nur77蛋白相互作用的活性,我们分别表达纯化了wtBcl-2,只含有结构区的Bcl-2/xl嵌合体(1~34 of Bcl-2,35~50 of Bcl-xl,92~207 of Bcl-2),以及Nur77的LBD结构域.我们运用NMR技术首先对15N标记的Nur77 LBD结构域与非标记的Bcl-2/xl嵌合体的相互作用进行研究,结果如图 3(a)所示,仅有极个别的峰有扰动,大部分谱峰没有明显的变化,说明不含loop区的Bcl-2蛋白与Nur77的LBD结构域相互作用较弱.紧接着我们运用非标记的wtBcl-2蛋白滴定15N标记的Nur77 LBD结构域蛋白,如图 3(b)所示,发现谱图具有明显的变化,大部分谱峰消失,说明与嵌合体相比,两者具有较强的相互作用.为了进一步验证二者的相互作用,我们运用非标记的Nur77 LBD结构域对15N标记的wtBcl-2蛋白进行反向滴定,结果如图 3(c)所示,发现其谱图在滴定过程中同样伴随着大部分谱峰的消失,进一步证实了我们通过变复性获得的wtBcl-2蛋白具有较高的活性.
图3
图3
野生型胞内全长Bcl-2(wtBcl-2)的活性验证.(a) 15N标记的Nur77 LBD结构域(wtNur77)加入非标记的Bcl-2/xl嵌合体的15N-1H TROSY谱;(b) 15N标记的wtNur77加入非标记的wtBcl-2的15N-1H TROSY谱;(c) 15N标记的wtBcl-2加入非标记wtNur77的15N-1H TROSY谱
Fig.3
Functional validation of wild type full-length Bcl-2 (wtBcl-2). (a) 15N-1H TROSY spectra of unlabeled Bcl-2/xl with 15N-labeled Nur77 LBD (wtNur77); (b) 15N-1H TROSY spectra of unlabeled wtBcl-2 with 15N-labeled wtNur77; (c) 15N-1H TROSY spectra of 15N-labeled wtBcl-2 with unlabeled wtNur77
2.3 T69E突变体的活性验证
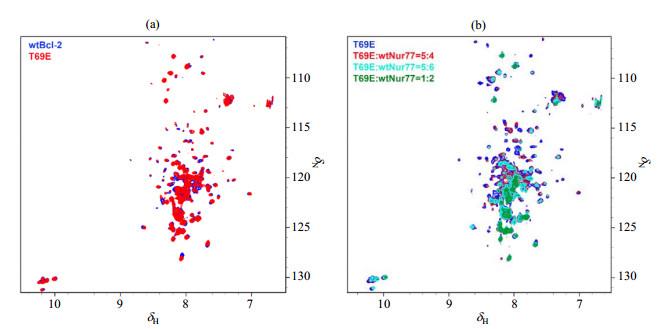
位于BH4和BH3基序之间无序loop区的T69是常见的Bcl-2磷酸化修饰位点.T69E被广泛应用于模拟磷酸化研究中,可以形成稳定的类磷酸化态.为了研究Bcl-2的磷酸化修饰对其与Nur77相互作用的影响,我们构建了T69E突变体,并表达纯化获得高纯度的可溶性蛋白质样品.通过采集一系列15N-1H TROSY谱图研究其对Bcl-2与Nur77相互作用的影响.如图 4(a)所示,我们首先比较了T69E突变体与wtBcl-2的NMR谱图,发现T69E突变体的谱峰信号相较野生型没有显著的变化,仅有一些残基受到扰动,说明T69位点的模拟磷酸化突变没有引起较大的结构扰动.我们向15N标记的T69E突变体中加入不同浓度的非标记Nur77 LBD结构域样品,并采集一系列谱图,如图 4(b)所示,发现T69E突变体的谱峰和野生型一样出现较明显的变化,大部分谱峰消失,说明T69E模拟磷酸化修饰后,结构上没有较大的变化,但仍然具有与Nur77相互作用的活性.
图4
图4
T69E突变体的功能验证.(a) 野生型胞内全长Bcl-2(wtBcl-2,蓝色)及其T69E突变体(红色)的15N-1H TROSY谱图比较;(b) Nur77 LBD(wtNur77)滴定T69E突变体的15N-1H TROSY谱图
Fig.4
Functional validation of T69E mutant. (a) 15N-1H TROSY spectra of wtBcl-2 (blue) and T69E mutant (red); (b) 15N-1H TROSY spectra of T69E mutant titrated with wtNur77
2.4 wtBcl-2及其T69E突变体与Nur77 LBD相互作用的亲和力比较
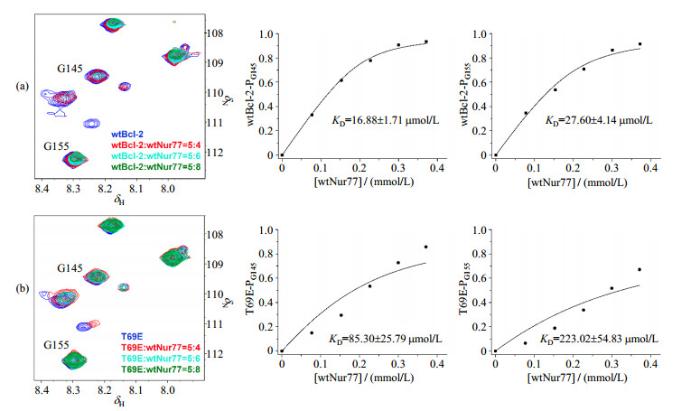
为获得wtBcl-2蛋白及其T69E突变体和Nur77 LBD结构域相互作用的定量信息,我们选择在Bcl-2 TROSY谱图上发生显著变化的G145和G155两个谱峰信号进行分析(归属参照文献[23]),随着Nur77 LBD浓度的增加,图 5(a)中wtBcl-2及图 5(b)中T69E突变体相应位点的谱峰信号逐渐消失,但是wtBcl-2信号的消失幅度明显大于T69E突变体.我们对谱峰进行积分,根据信号强度的消失程度计算与Nur77 LBD相结合的Bcl-2蛋白占所有Bcl-2蛋白的比例.然后使用Origin软件进行数据处理,根据(2)式拟合曲线,分别计算wtBcl-2和T69E突变体的各个位点与Nur77 LBD结构域相互作用的解离常数
图5
图5
野生型胞内全长Bcl-2(wtBcl-2)及其T69E突变体与Nur77 LBD结构域(wtNur77)解离常数(KD)的拟合.(a) wtNur77滴定wtBcl-2的15N-1H TROSY谱图和数据拟合;(b) wtNur77滴定T69E突变体的15N-1H TROSY谱图和数据拟合
Fig.5
Data fitting of the dissociation constants between wtBcl-2 or T69E mutant and wtNur77. (a) 15N-1H TROSY spectra and the fitting plots of wtBcl-2 titrated with wtNur77; (b) 15N-1H TROSY spectra and the fitting plots of T69E mutant titrated with wtNur77
3 结论
我们通过变复性方法获得了可溶性wtBcl-2蛋白,用Western Blot、CD谱验证了其复性后是具有二级结构的目的蛋白,并通过NMR实验获得了Bcl-2蛋白和Nur77 LBD结构域在原子水平分辨率上的相互作用信息[24, 25].我们的研究结果发现,与wtBcl-2对比,嵌合体Bcl-2/xl与Nur77的结合能力明显减弱,证明loop区的存在对于Bcl-2与Nur77的相互作用至关重要.我们运用T69E模拟Bcl-2的磷酸化,并对wtBcl-2及其T69E突变体与Nur77 LBD结构域的亲和力进行定量研究,发现T69E突变体的亲和力减弱,相比野生型有7倍左右的差异,表明Bcl-2 loop区的磷酸化修饰可以调控Bcl-2与Nur77的相互作用.我们的研究结果对基于Bcl-2和Nur77信号转导通路的研究和抗癌药物的设计具有一定的参考价值.
无
参考文献
Programmed cell death in animal development
[J].DOI:10.1016/S0092-8674(00)81873-5 [本文引用: 1]
Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy
[J].
Systems biology of apoptosis signaling networks
[J].DOI:10.1016/j.copbio.2010.07.001 [本文引用: 1]
Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3
[J].DOI:10.1016/S0092-8674(00)80501-2 [本文引用: 1]
Apoptosis: a review of programmed cell death
[J].DOI:10.1080/01926230701320337 [本文引用: 1]
Embedded together: the life and death consequences of interaction of the Bcl-2 family with membranes
[J].DOI:10.1007/s10495-007-0746-4 [本文引用: 1]
The BCL-2 protein family: opposing activities that mediate cell death
[J].
The BCL-2 family reunion
[J].DOI:10.1016/j.molcel.2010.01.025 [本文引用: 5]
Solution structure of the antiapoptotic protein bcl-2
[J].DOI:10.1073/pnas.041619798 [本文引用: 4]
Cytochrome c release and apoptosis induced by mitochondrial targeting of nuclear orphan receptor TR3
[J].DOI:10.1126/science.289.5482.1159 [本文引用: 1]
Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77/TR3
[J].DOI:10.1016/S0092-8674(04)00162-X [本文引用: 1]
A short Nur77-derived peptide converts Bcl-2 from a protector to a killer
[J].DOI:10.1016/j.ccr.2008.09.002 [本文引用: 4]
Posttranslational modification of Bcl-2 facilitates its proteasome-dependent degradation: molecular characterization of the involved signaling pathway
[J].DOI:10.1128/MCB.20.5.1886-1896.2000 [本文引用: 1]
Phosphorylation of Bcl-2 protein by CDC2 kinase during G2/M phases and its role in cell cycle regulation
[J].
Serine-70 is one of the critical sites for drug-induced Bcl2 phosphorylation in cancer cells
[J].
Survival factor-induced extracellular signal-regulated kinase phosphorylates BIM, inhibiting its association with BAX and proapoptotic activity
[J].DOI:10.1073/pnas.0406837101 [本文引用: 1]
BCL-2 is phosphorylated and inactivated by an ASK1/Jun N-terminal protein kinase pathway normally activated at G(2)/M
[J].DOI:10.1128/MCB.19.12.8469 [本文引用: 1]
Survival function of ERK1/2 as IL-3-activated, staurosporine-resistant Bcl2 kinases
[J].DOI:10.1073/pnas.97.4.1578 [本文引用: 1]
Mono- and multisite phosphorylation enhances Bcl2's antiapoptotic function and inhibition of cell cycle entry functions
[J].DOI:10.1073/pnas.2533920100 [本文引用: 1]
Unwinding the loop of Bcl-2 phosphorylation
[J].DOI:10.1038/sj.leu.2402134 [本文引用: 1]
A novel recombinant expression and purification approach for the full-length anti-apoptotic membrane protein Bcl-2
[J].
NMR studies of weak protein-protein interactions
[J].DOI:10.1016/j.pnmrs.2012.11.002 [本文引用: 1]
The interaction of alpha-synuclein and intact mitochondria studied by NMR
[J].
Alpha-突触核蛋白与完整线粒体相互作用的NMR研究
[J].
NMR research on the clpC operon binding region of transcription factor CtsR from Bacillus subtilis
[J].
Bacillus subtilis转录因子CtsR蛋白中DNA结合区域的NMR研究
[J].