引言
磁共振成像(MRI)作为一种非侵入性且无放射性的成像技术,是长期以来被用作医学诊断的重要影像学工具之一[1, 2].相比于其他医学影像技术,如计算机断层扫描(CT)、正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT)等技术,MRI具有诸多优势,包括对检查对象无损无创,可以获取具有高空间分辨率和软组织对比度的三维图像信息等[3-5].然而,MRI在医学诊断中也存在灵敏度相对较低的缺点,目前主要的解决方法是通过增强成像对比度来提高MRI的灵敏度[6].MRI造影剂的应用可以有效增强组织对比度,该策略得到科学家的广泛关注并在近年发展迅速,其作用机制一般是缩短目标部位质子的弛豫时间,包括质子的自旋-晶格或纵向弛豫时间(T1),及自旋-自旋或横向弛豫时间(T2).简而言之:T1越短,图像信号越强(正增强);T2越短,图像信号越弱(负增强)[7].
MRI造影剂的效率通常用弛豫率(包括纵向弛豫率r1=1/T1或横向弛豫率r2=1/T2)表示,即能够缩短每毫摩尔造影剂弛豫时间的能力[8].根据显像特点,通常可将MRI造影剂分为两类:T1造影剂(阳性造影剂)和T2造影剂(阴性造影剂)[9].T1造影剂的作用主要是缩短T1,从而产生明亮的图像,一般是钆(Gd3+)[1, 10-12]或锰(Mn2+)[13]等顺磁性化合物,例如钆的螯合物[14-17].由于Gd的强顺磁性,钆螯合物造影剂可明显缩短质子的T1,增强对比度,是临床常用的造影剂.但钆螯合物在临床上的应用也存在一些缺点:如体内循环时间短,从而影响需要较长扫描时间的成像的分辨率;不易对其进行功能化修饰;另外具有诱发肾功能受损患者(尤其是老年患者)肾源性系统纤维化(NSF)的风险[18].T2造影剂主要起到缩短T2的作用,从而产生信号减弱的图像,即暗图像.超顺磁性纳米颗粒(通常是氧化铁纳米颗粒[19-22])由于具有较高的r2、良好的生物相容性和较长的体内循环时间而被广泛用作T2造影剂,但它在临床上的应用主要受到负造影效果和磁敏感伪影的限制:暗信号的产生可能会误导基于T2加权磁共振图像的临床诊断,而且该信号容易与出血[11, 23]、钙化[24]或金属沉积[25]的信号混淆;而磁敏感伪影通常会使背景图像失真[26].鉴于这些原因,相比T2造影剂,T1造影剂在精准的高分辨率成像上更具优势.
为了克服上述顺磁性螯合物的缺点,近年来基于无机纳米颗粒的T1-T2双模态MRI造影剂得到了广泛的研究[27-32].与顺磁性螯合物相比,基于纳米颗粒的造影剂具有很多受益于其纳米结构的优势:1、造影剂的磁性质可根据纳米颗粒的尺寸、性质、组成和组装方式进行调整;2、纳米颗粒的体内循环时间更长,临床应用更具潜力;3、纳米颗粒的表面易于修饰,可与靶向基团或其他探针结合,从而实现靶向和多模态成像[33].理论上,T1-T2双模态MRI造影剂可通过T1造影剂和T2造影剂的杂合来获得.近年来,已有多种基于无机纳米颗粒的T1-T2双模态MRI造影剂被开发,例如超小Fe3O4[29]磁性纳米颗粒(粒径约为5 nm).然而,尽管有机纳米颗粒造影剂的功能化修饰更具优势,但目前对其研究仍较少.
近年有研究[34]报道了一种含钆的有机纳米颗粒,其制备是基于具有生物相容性的1, 2-氨基硫醇和氰基苯并噻唑(CBT)的缩合反应,该研究证明了基于CBT的含钆小分子可通过缩合反应生成疏水性的低聚物,这些低聚物会进一步自组装形成超分子纳米颗粒,可作为T1造影剂. 在相同Gd3+浓度下,这些纳米颗粒相比含钆小分子前体表现出增强的纵向弛豫率. 然而,含钆纳米颗粒体系作为T2造影剂的研究鲜有报道[35].由于纳米颗粒的粒径影响弛豫率,不同粒径的含钆纳米颗粒有可能作为T1或T2造影剂,因此含钆纳米颗粒具有成为T1-T2双模态MRI造影剂的潜力,以有效提高MRI的灵敏度. 本文设计合成了一种新型的粒径动态变化的有机钆纳米颗粒,随着粒径的增大,其制备过程包含从小分子到低聚物再到纳米颗粒的动态过程.本文还对合成的纳米颗粒进行T1加权和T2加权成像,观察纵向弛豫率和横向弛豫率随时间的连续变化,验证该系统可以先作为T1造影剂,然后逐渐转变为T2造影剂的潜力.使用同一造影剂的阳性和阴性MRI将显著提高检测的准确性.
1 实验部分
1.1 仪器和试剂
仪器:AVANCE 400微成像核磁共振(NMR)谱仪(Bruker,德国),Evolution 220紫外分光光度计(Thermo Fisher Scientific,美国),ZEN3690动态光散射(DLS)仪(Malvern,英国),6530 Q-TOF四级杆飞行时间质谱仪(Agilent,美国),HITACHI H-7000 FA透射电子显微镜(TEM)(HITACHI H,日本),THZ-C-1恒温振荡器(太仓市实验设备厂,中国).
试剂:Cys(SEt)-Lys[DOTA(Gd)]-CBT(钆前体)、三(2-羧乙基)膦(TCEP)购自萨恩化学技术(上海)有限公司;碳酸钠购自国药集团化学试剂有限公司.
1.2 动态有机钆纳米颗粒的制备
分别配制100 μmol/L的Cys(SEt)-Lys[DOTA(Gd)]-CBT(钆前体)水溶液和4 mmol/L的TCEP水溶液;将钆前体水溶液和TCEP水溶液混合,钆前体和TCEP的摩尔比为25:1,在室温下搅拌0.5 h,得到钆中间体;将钆中间体用Na2CO3水溶液调节pH值至6.0,在室温下搅拌不同时间,得到不同粒径的钆纳米颗粒.
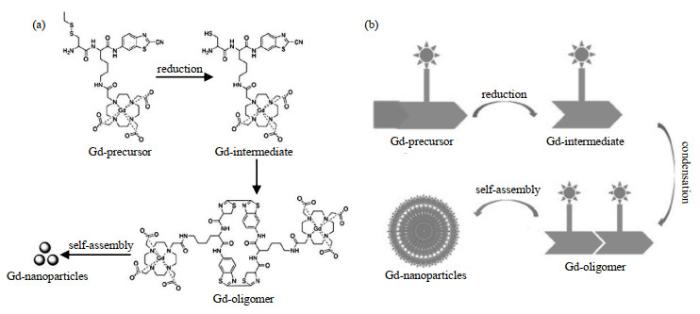
动态有机钆纳米颗粒的合成线路如图 1(a)所示,其合成原理如图 1(b)所示.由图 1可知,有机钆纳米颗粒的制备是基于具有生物相容性的1, 2-氨基硫醇和CBT的缩合反应进行寡聚和组装,其成像功能模块为Gd-DOTA螯合物.含钆前体分子(Gd-precursor)在TCEP的还原作用下生成1, 2-氨基硫醇基团(Gd-intermediate),随后与CBT的氰基发生缩合反应,形成粒径更大、疏水性更强的低聚物(Gd-oligomer),再进一步自组装形成有机钆纳米颗粒(Gd-nanoparticle).在颗粒间疏水作用的驱动下,自组装的纳米颗粒逐渐增大,该体系涉及从小分子到低聚物,再到纳米颗粒的动态过程.有机钆纳米颗粒的粒径在调节pH后随时间变化而逐渐增大.
图1
图1
动态有机钆纳米颗粒的合成. (a)合成线路;(b)合成原理
Fig.1
Synthesis route (a) and the scheme (b) from small organic Gd-containing molecules to oligomers, and then to different-sized nanoparticles
1.3 动态有机钆纳米颗粒的表征
使用质谱(MS)和紫外-可见吸收(UV-Vis)光谱验证钆纳米颗粒的结构;使用DLS仪测定0.5 mg/mL钆纳米颗粒的水合粒径;使用HITACHI H-7000 FA透射电子显微镜(TEM)拍摄钆纳米颗粒的形貌,检测时,先用纯水配置浓度为0.5 mg/mL的钆纳米颗粒水溶液,再使用10 μL移液枪移取1滴溶液至普通铜网碳支持膜上,自然风干后,将铜网放置在透射电镜下观察.
1.4 动态有机钆纳米颗粒弛豫率测定和磁共振图像采集
分别配置Gd3+浓度为5、10、20、50和100 mmol/L的钆纳米颗粒水溶液,置于5 mm NMR样品管中,在Bruker AVANCE 400微成像NMR谱仪上进行测试.
T1测量使用多层多回波(MSME)序列:成像视野(FOV)= 3 cm×3 cm,回波时间(TE)= 7 ms,重复时间(TR)= 40、70、100、180、300、500、750、1 000、1 500、3 000、5 000 ms,矩阵(Matrix)= 64×64,累加次数为2,片厚/间隔(Slice Thickness/Gap)= 1 mm/0.1 mm.
T1加权图像采集时,FOV = 3 cm×3 cm,TE/TR = 8.5 ms/1 000 ms,Matrix = 64×64,累加次数为2,Slice Thickness/Gap = 0.8 mm/0.2 mm.
T2测量使用MSME序列:FOV = 3 cm×3 cm,TE = 8~480 ms,TR = 3 000 ms,Matrix = 64×64,累加次数为2,Slice Thickness/Gap = 1 mm/0.1 mm.
T2加权图像采集时,FOV=3 cm×3 cm,TE/TR = 100 ms/3 000 ms,Matrix = 64×64,累加次数为2,Slice Thickness/Gap = 0.8 mm/0.2 mm.
2 结果与讨论
2.1 动态有机钆纳米颗粒的表征
2.1.1 Gd-oligomer的MS表征
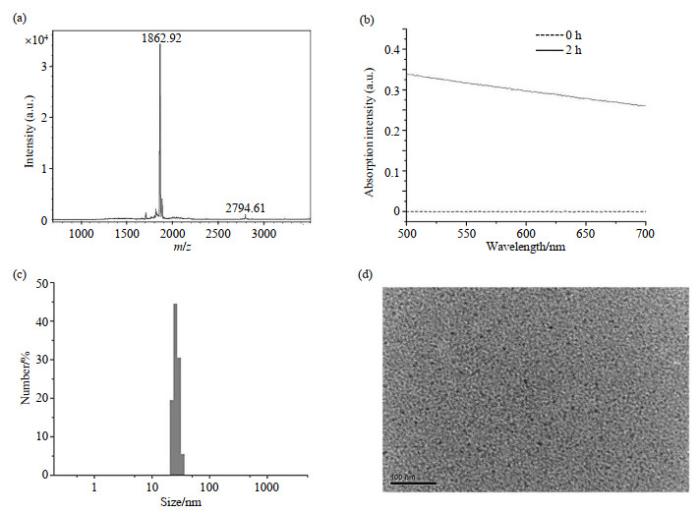
为表征1, 2-氨基硫醇和CBT的缩合反应,将制备的Gd-oligomer在正离子模式下进行基质辅助激光解吸/电离-质谱(MALDI-MS)测试,质谱图[图 2(a)]显示其分子离子峰为1 862.92,证实发生了缩合反应,该缩合反应生成了二聚体Gd-oligomer.
图2
图2
有机钆纳米颗粒的表征. (a)低聚物混合物的MALDI-MS谱图;(b)加入TCEP,未调节pH(0 h)和调节pH后2 h的紫外-可见吸收光谱;(c) 调节pH后2 h的水合粒径图;(d) 调节pH后2 h有机钆纳米颗粒的透射电子显微镜照片
Fig.2
Characterizations of organic gadolinium system. (a) MALDI-MS spectrum of the Gd-oligomer mixtures; (b) UV-Vis absorption spectra of organic gadolinium system with TCEP just as prepared (0 h) and after adjusting pH for 2 h; (c) Hydrodynamic diameters of organic Gd-nanoparticles after adjusting pH for 2 h detected by DLS; (d) TEM image of Gd-nanoparticles after adjusting pH for 2 h
2.1.2 动态有机钆纳米颗粒的UV-Vis光谱分析
图3
图3
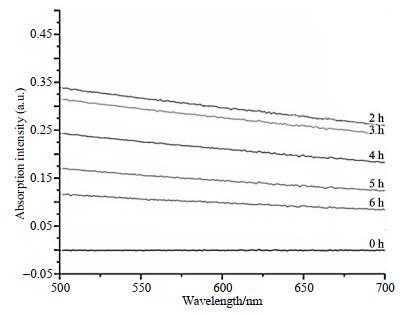
调节pH后不同反应时间的有机钆纳米颗粒的紫外-可见吸收光谱
Fig.3
UV-Vis absorption spectra of Gd-nanoparticles at different time points after adjusting pH
2.1.3 动态有机钆纳米颗粒的DLS分析
图4
图4
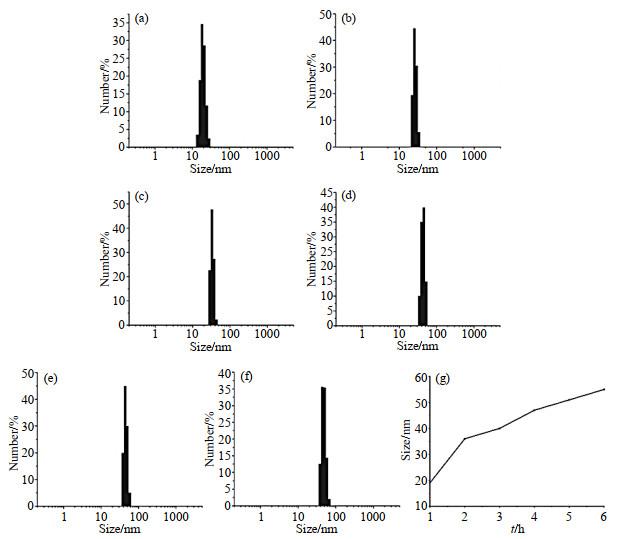
DLS测得的调节pH后不同反应时间的有机钆纳米颗粒的粒径.(a) 1 h;(b) 2 h;(c) 3 h;(d) 4 h;(e) 5 h;(f) 6 h;(g)平均粒径随反应时间的变化
Fig.4
The values of Gd-nanoparticles size measured by DLS after adjusting pH for (a) 1 h, (b) 2 h, (c) 3 h, (d) 4 h, (e) 5 h, (f) 6 h; (g) The variation curve of the average particles size with reaction time
2.1.4 动态有机钆纳米颗粒的TEM表征
2.2 动态有机钆纳米颗粒用于造影剂的MRI实验
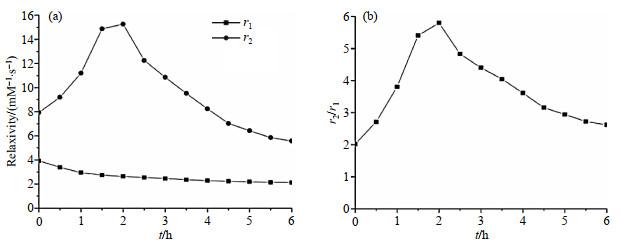
利用Bruker AVANCE 400微成像NMR谱仪对调节pH后的钆纳米颗粒以0.5 h为时间间隔进行T1加权和T2加权体外水管成像(图 5),并采集T1和T2.将采集的T1和T2数据进行作图,所得的r1和r2随反应时间的变化曲线如图 6(a)所示,由图 6(a)和图 5可知,钆纳米颗粒的纵向弛豫率r1随时间单调减小;而横向弛豫率r2表现出非单调时间依赖性,即先增加,在一定时间后再减小.具体表现为:纵向弛豫率r1在调节pH后0.5 h时为3.4 mM−1⋅s−1(1 M=1 mol/L),6 h时逐渐降低为2.1 mM−1⋅s−1;横向弛豫率r2在调节pH后0.5 h时为9.2 mM−1⋅s−1,2 h时增加至15.3 mM−1⋅s−1,6 h时降低至5.6 mM−1⋅s−1.
图5
图5
调节pH后不同反应时间的有机钆纳米颗粒的(a) T1加权磁共振图像和(b) T2加权磁共振图像
Fig.5
(a) T1-weighted and (b) T2-weighted magnetic resonance images of Gd-nanoparticles at different time points after adjusting pH
图6
图6
调节pH后不同反应时间的有机钆纳米颗粒的(a) r1、r2和(b)弛豫比(r2/r1)
Fig.6
Values of (a) r1, r2, and (b) relaxation ratio (r2/r1) of Gd-nanoparticles at different time points after adjusting pH
除纵向弛豫率r1和横向弛豫率r2外,另一个表征弛豫效率的指标是弛豫比r2/r1,它决定了造影剂是作为T1造影剂还是T2造影剂:对于T1造影剂,r2/r1越小越好;而对于T2造影剂,r2应大于r1,r2/r1应尽可能高.钆纳米颗粒的弛豫比r2/r1随时间的变化如图 6(b)所示,r2/r1在调节pH后0.5 h时为2.71,2 h时增加至5.80,6 h时降低至2.62,这对应于钆纳米颗粒的粒径从8 nm增大至23 nm.
钆纳米颗粒纵向弛豫率的逐渐降低归因于与Gd3+结合的水分子数量随纳米颗粒粒径的增大而减少,因此,钆纳米颗粒作为T1造影剂的最佳粒径为8 nm.钆纳米颗粒粒径的增大导致r1降低,以及r2先增大后减小.因此,钆纳米颗粒粒径的轻微增加会引起r2/r1的明显提高,2 h时,粒径达到约10 nm,弛豫比r2/r1达到最大值5.80,可以推断钆纳米颗粒作为T2造影剂的最佳粒径为10 nm.因此,随着时间的推移,钆纳米颗粒造影剂从T1造影剂过渡到T2造影剂. 与其他T1-T2双模态MRI造影剂不同,钆纳米颗粒体系经历了从小分子到低聚物再到纳米颗粒的动态过程,并在不同阶段呈现T1造影剂到T2造影剂的过渡.因此,该动态钆纳米颗粒在自组装的不同阶段可以分别作为T1造影剂和T2造影剂.
3 结论
本文制备了一种动态有机钆纳米颗粒,其MRI功能模块为Gd-DOTA螯合物,基于具有生物相容性的1, 2-氨基硫醇和CBT的缩合反应,形成粒径更大、疏水性更强的低聚物,再进一步自组装形成有机钆纳米颗粒.其粒径可动态变化,可在其自组装的不同阶段分别作为T1造影剂和T2造影剂,使用同一造影剂即可实现MRI信号正增强和负增强效果,可有效提高检测的准确性.有机钆纳米颗粒易于修饰,通过合适的化学修饰方法可赋予其环境响应性或靶向性等功能,具有广泛的应用前景.本文工作已申请名为“一种动态有机钆纳米颗粒及其应用”的专利,申请号:202110327892.6.
参考文献
Challenges for molecular magnetic resonance imaging
[J].DOI:10.1021/cr100025t [本文引用: 2]
Chemistry of MRI contrast agents: current challenges and new frontiers
[J].DOI:10.1021/acs.chemrev.8b00363 [本文引用: 1]
Dendrimer-based molecular imaging contrast agents
[J].DOI:10.1016/j.progpolymsci.2014.08.002 [本文引用: 1]
Snapshot FLASH MRI. Applications to T1, T2, and chemical-shift imaging
[J].
The role of MRI in rectal cancer: An updated review
[J].DOI:10.1007/s40134-020-00362-2 [本文引用: 1]
Magnetic resonance imaging: progresses and perspective
[J].
磁共振成像发展综述
[J].
Safety of magnetic resonance imaging contrast agents
[J].DOI:10.1002/(SICI)1522-2586(199909)10:3<477::AID-JMRI33>3.0.CO;2-E [本文引用: 1]
Inorganic nanoparticle-based T1 and T1/T2 magnetic resonance contrast probes
[J].DOI:10.1039/c2nr31865b [本文引用: 1]
Nuclear magnetic resonance spectroscopy and imaging
[J].
磁共振波谱与成像技术
[J].
Gadolinium labelled nanoliposomes as the platform for MRI theranostics: in vitro safety study in liver cells and macrophages
[J].DOI:10.1038/s41598-020-60284-z [本文引用: 1]
Neurotoxicity of subarachnoid Gd-based contrast agent accumulation: a potential complication of intraoperative MRI?
[J].DOI:10.3171/2020.10.FOCUS20402 [本文引用: 1]
Pharmacokinetic modeling of Gadolinium nanoparticles (Gd-NPs) with the sojourn time in vasa vasorum for the contrast enhanced MRI
[J].
Manganese-based contrast agents for MRI
[J].
锰对比剂在MRI中的应用
[J].
Gadolinium(Ⅲ) chelates as MRI contrast agents: structure, dynamics, and applications
[J].DOI:10.1021/cr980440x [本文引用: 1]
GD-DTPA enhanced MRI of ocular transport in a rat model of chronic glaucoma
[J].DOI:10.1016/j.exer.2008.06.015
Surface modification of PLGA nanospheres with Gd-DTPA and Gd-DOTA for high-relaxivity MRI contrast agents
[J].DOI:10.1016/j.biomaterials.2010.07.095
Fabrication of Gd-DOTA-functionalized carboxylated nanodiamonds for selective MR imaging (MRI) of the lymphatic system
[J].
Gadolinium-based MR contrast agents and nephrogenic systemic fibrosis1
[J].DOI:10.1148/radiol.2423061640 [本文引用: 1]
pH-responsive theranostic nanocomposites as synergistically enhancing positive and negative magnetic resonance imaging contrast agents
[J].DOI:10.1186/s12951-018-0350-5 [本文引用: 1]
pH-sensitive magnetite nanoparticles modified with hyperbranched polymers and folic acid for targeted imaging and therapy
[J].DOI:10.2174/1567201816666191002102353
Synthesis of PEOlated Fe3O4@SiO2 nanoparticles via bioinspired silification for magnetic resonance imaging
[J].
Synthesis of folic acid-modified Fe3O4 nano-magnetic fluid for in vivo tumor cell labeling
[J].DOI:10.5897/AJPP12.1391 [本文引用: 1]
Cerebral microbleed detection on 7 T MRI: Reliability and effects of image processing
[J].
Identification of calcification with MRI using susceptibility-weighted imaging: A case study
[J].DOI:10.1002/jmri.21617 [本文引用: 1]
Imaging hippocampus of mental patients with BLADE technique
[J].
刀锋伪影校正技术在精神疾病患者海马MRI检查中的应用
[J].
Targeted dual-contrast T1- and T2-weighted magnetic resonance imaging of tumors using multifunctional gadolinium-labeled superparamagnetic iron oxide nanoparticles
[J].DOI:10.1016/j.biomaterials.2011.03.018 [本文引用: 1]
Tuning the relaxation rates of dual-mode T1/T2 nanoparticle contrast agents: a study into the ideal system
[J].
Core/shell Fe3O4/Gd2O3 nanocubes as T1-T2 dual modal MRI contrast agents
[J].DOI:10.1039/C6NR02620F [本文引用: 1]
T1 and T2 dual-mode MRI contrast agent for enhancing accuracy by engineered nanomaterials
[J].
Albumin-based nanoparticles loaded with hydrophobic gadolinium chelates as T1-T2 dual-mode contrast agents for accurate liver tumor imaging
[J].
A synergistically enhanced T1-T2 dual-modal contrast agent
[J].DOI:10.1002/adma.201203169 [本文引用: 1]
A magnetic resonance-fluorescent dual-mode imaging probe for stem cell tracking
[J].
一种示踪干细胞的磁共振-荧光双模成像探针
[J].
Controlled self-assembling of gadolinium nanoparticles as smart molecular magnetic resonance imaging contrast agents
[J].DOI:10.1002/anie.201007018 [本文引用: 1]
A new Gd-based T2-weighted magnetic resonance imaging contrast agent: preparation and application in stem cell imaging
[J].
新型Gd基T2造影剂的制备和应用
[J].