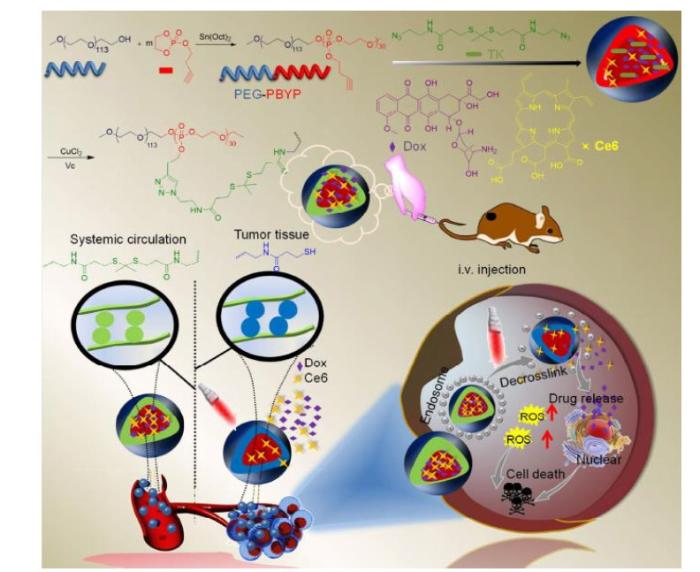
引言
1 聚合物胶束的简介
分子探针在生物体内的分布极大影响了最终的成像效果.为使肿瘤区域的对比增强,一方面要避免分子探针被免疫系统吞噬和代谢,另一方面要尽可能延长探针的血液循环时间以增加肿瘤区域的富集浓度.由于其本身的高通透性和滞留效应(EPR),肿瘤部位更倾向于蓄积粒径大小在30~200 nm左右的大分子.胶束结构的多样性使得研究者可以按照需求更改重复单元的结构和数量,以设计合成合适粒径的胶束分子.同时,聚合物胶束的外壳通常由亲水性的材料组成,如聚乙二醇(PEG)、聚环氧乙烷(PEO)、聚乙烯吡咯烷酮(PVP)等.该亲水端不仅能够帮助胶束体系稳定地分散在水溶液中,避免聚集沉降;而且使其进入生物体后能够躲避免疫细胞的吞噬,延长在血液中的循环时间,负载更多的药物或者造影剂到达肿瘤部位[7-9].MRI因具有组织对比度高、无放射性、时间空间分辨率较高等优点在临床上得到广泛应用,但传统的1H MRI灵敏度较低,需要注射造影剂以增强对比.对于一些具有特殊功能链段的胶束,如聚N-异丙基丙烯酰胺(PNIPAM)、聚己内酯(PCL)、聚天冬氨酸(PAsp)等温度及pH敏感型链段[10],其具有的环境响应型特性正好有助于提高成像的灵敏度和特异性.表 1列出了一些常用的共聚物作为胶束型MRI造影剂载体的应用概述.
表1 一些常用的聚合物作为胶束型MRI造影剂载体的应用概述
Table 1
2 胶束型磁共振造影剂的类型
基于聚合物胶束在临床应用中的优点,将其作为传统磁共振造影剂的载体,可以进一步提高造影剂的运输效率,同时胶束表面也可以修饰一些具有靶向性的基团从而与病变部位的靶点进行特异性结合,实现对疾病的特异性检测.以聚合物胶束作为载体的新型MRI造影剂主要可以分为以钆等顺磁性金属为基础的T1正增强显影剂和以超顺磁性氧化铁(SPIO)纳米颗粒为主的T2负增强显影剂,以及以化学交换方法获得信号提高的化学交换饱和转移(CEST)造影剂等.
2.1 聚合物胶束作为T1 MRI造影剂的载体
T1加权成像是借由不同组织自身所具有的不同T1时间而获得的对比成像,通过引入带有未配对电子的顺磁性金属可以增加顺磁弛豫率,进一步提高病变区域与正常组织的T1加权像的对比度.但顺磁性金属离子本身具有较高的生理毒性,因此自1984年Weinmann等[40]研发出以二亚乙基三胺五乙酸钆(Gd-DTPA)为代表的T1造影剂以来,当前主要以DTPA、1, 4, 7-三叔丁氧羰基-1, 4, 7, 10-四氮杂环十二烷(DOTA)及其衍生物等螯合物与顺磁性金属配位作为造影剂分子探针进行MRI检测.但是这种小分子造影剂在体内血液循环半衰期短,没有靶向性,且有金属离子泄露的危险.为解决上述问题,胶束作为一种具备独特优势的药物载体而被应用于装载造影剂分子.
2018年,Shiraishi等[41]使用PEG-Plys包裹Gd-DOTA,以24只BALB/c小鼠为研究对象,采用1 T MRI设备检测淋巴结里富集的造影剂含量,进行了造影剂的血液循环半衰期实验,结果显示胶束包裹的Gd-DOTA拥有更长的血液循环半衰期(达到6 h左右),比单独使用Gd-DOTA提高了近3倍,且成像灵敏度也有相应的提高—Gd分子使用检测量低至0.5 μmol·L-1.Ji等[42]开发了一种装载化疗药物阿霉素(DOX)和MRI造影剂(Gd-DTPA)的多功能磷酸钙纳米颗粒(A54-CaP/Gd-DTPA/DOX),用于通过T1加权MRI实时视觉靶向治疗肝癌.Zhou等[43]合成了聚多巴胺-聚腺苷酸(PDOPA-Psar)的共聚物胶束,该胶束能够螯合多种金属离子,如Mn2+、Gd3+、Ga2+等.作者着重研究了胶束螯合Mn2+作为T1造影剂的成像效果,在水溶液中其纵向弛豫率可达27.7 mM-1·s-1(1 M=1 mol/L),比负载Gd3+的效果更好(16.4 mM-1·s-1),作者推测这是因为该胶束负载Gd3+的效率比较低,只有19%,远不及Mn2+的84%.
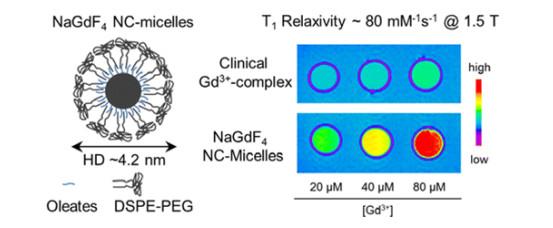
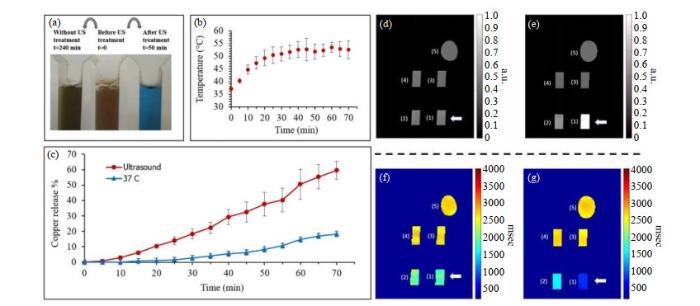
利用胶束核壳结构的特点,一些研究者对核层的选择和粒径进行了充分研究以提高造影剂的负载效果.Almutairi等[44]使用PEG化的磷脂胶束(DSPE-PEG)包裹NaGdF4晶体(3 nm),通过控制水质子与顺磁性晶体表面的接近程度,实现了比临床使用的Gd3+螯合物高约25倍的超高T1弛豫率.如图 1所示,与仅具有单个顺磁中心的临床Gd3+配合物相比,具有大量受限Gd3+的顺磁钆基纳米晶体(NCs)有望大大增强水质子的纵向弛豫.实验表明可以通过控制晶体胶束尺寸来调整水质子到NCs表面的距离,在胶束化过程中增加DSPE-PEG与NCs的比例会减小NCs胶束的大小,从而增强水与NCs表面的接近度.作者使用这种策略获得了紧凑的NCs胶束(流体动力学直径HD≈5 nm),在1.41 T磁场强度下,每个Gd3+具有约80 mM-1·s-1的超高T1弛豫率.Azhari等[45]研究了在MRI和超声中都具有对比度增强效果的氧化铜纳米粒子(CuO NPs)造影剂(图 2).该文章通过超声诱导的热疗方式从胶束中包封和释放CuO NPs,并利用MRI监测该过程.作者制备了负载CuO NPs的聚(乙二醇)-嵌段-聚(D, L-乳酸)(PEG-b-PLA)胶束;然后,使用比色法研究了使用超声加热(US)对胶束纳米载体中铜释放的影响;最后,分别得到使用US处理后的CuO NPs胶束悬浮液样品和使用US处理后的含有CuO NPs胶束的离体家禽肝脏样品的T1加权磁共振图像.结果证实:(ⅰ)封装的NPs可通过MRI检测,T1弛豫时间从1 872±62 ms大幅度缩短到683±20 ms;(ⅱ)超声波热疗刺激了CuO NPs的释放,与未经处理的样品相比,释放速率增加了约3倍;(ⅲ)T1加权成像清晰可见释放效果(T1加权信号增加了2.29倍).这些发现可能有利于将基于CuO NPs的治疗诊断开发为一种新的无创方法.
图1
图2
图2
超声加热(US)对胶束纳米载体中铜释放的影响和MRI检测.(a)三个装有PEI胶束的比色皿的照片:(左)在室温下4 h后,未经US处理;(中)基线解决方案(初始状态);(右)经过50 min的US处理.(b) US处理引起的温度升高.(c)经过US处理和未经US处理溶液的所得铜释放百分比与时间的关系(n=3).(d, f)未经US处理和(e, g) US处理后的(d, e) MRI T1加权和(f, g) T1伪彩图像[45]
Fig.2
Influence of ultrasound heating on copper release from micelle nanocarriers and MRI detection. (a) Photos of three cuvettes containing loaded micelles with PEI: (Left) After 4 h at room temperature without US treatment; (Middle) Baseline solution (initial state); (Right) After US treatment for 50 min. (b) The temperature elevation resulting from the US. (c) The resulting copper release percentages as a function of time (n=3) for both US treated and untreated solutions. Note the substantial effect of the (d, e) MRI T1 weighted and (f, g) T1 mapping images of cuvettes (d, f) before and (e, g) after US treatment[45]
Gao等[46]以DOTA为功能单元和构筑结合点,构建了一系列具有多个螯合孔的DOTA支化有机骨架.这些巨型螯合剂因具备纳米级的柔软结构而展示出良好的特性.进一步实验表明,与传统的小分子DOTA螯合剂相比,它们能更加有效地吸附金属离子,并且更加稳定;其与Gd3+、Tb3+或两者同时螯合的多核配合物表现出优异的成像性能、良好的周边修饰可行性和高动力学稳定性.这种新型的大分子和配体支化策略可以很容易地扩展到制备多功能的多核配合物和核/壳多核配合物,为设计和构建下一代用于生物医学的高性能和高稳定性的多金属试剂提供了新途径.
2.2 胶束作为T2 MRI造影剂的载体
T2加权成像的本质是通过改变磁场的不均匀度,获得不同组织部位长短不同的T2弛豫时间.T2加权像中,造影剂富集部位会呈现明显弱于其他部位的暗影.因此传统的T2造影剂一般选择具有可以影响磁场的SPIO纳米颗粒或其他顺磁性金属氧化物,如已经投入到临床使用的菲立磁[47],使得目标区域在磁共振图像中更暗.
基于聚合物胶束作为药物载体的诸多优势,以及SPIO表面可功能化、可与两亲性链段相互作用的特点,研究人员开发了多种以胶束作为载体的T2型造影剂.Lin课题组[48]将SPIO包埋在树枝状聚合物超分子胶束(图 3)中,其显示出比单独使用SPIO高4倍的T2弛豫率以及高效的交变磁场引导的药物释放特性.随后Yang等[49]开发了靶向活化血小板的环状精氨酰-甘氨酰-天冬氨酸多肽(cRGD)功能化脂质体,观察血栓形成的双模态MRI.作者制备了包裹Gd-DTPA和SPIO的cRGD功能化脂质体(cRGD@MLP-Gd),并在体外分别采集了cRGD@MLP-Gd的血栓靶向T1和T2磁共振图像,同时测试了该脂质体具有的T1-T2对比度协同增强成像效果.体内实验结果表明,cRGD@MLP-Gd可以主动结合活化的血小板,并在血栓部位逐渐积累.在体内MRI实验中,cRGD@MLP-Gd在静脉给药1 h后表现出T2对比度增强,随后在血栓部位出现明显更大的T1对比度增强,具有协同增强的T1和T2双模态MRI成像效果.Cheng等[50]则描述了一种新型的可生物降解的纳米平台,用于将临床使用的光动力疗法(PDT)的光敏剂苯并卟啉衍生物-单酸环A(BPD-MA)递送至肿瘤.具体而言,疏水光敏剂BPD与葡聚糖-b-寡聚(酰胺胺)(DOA)树枝状共聚物上的胺基共价结合,形成两亲性葡聚糖-BPD共轭物,可在水中自组装成纳米级胶束,使用光敏剂作为疏水性结构单元能够实现简便且可重复的合成和高载药量;为了赋予这些胶束额外的成像能力,将SPIO封装在疏水核内,作为MRI造影剂.
图3
当前,以聚合物胶束作为T1、T2磁共振造影剂的载体的应用还有很多,利用其结构特性,还可以设计一系列功能化了的靶向性分子,以及进行药物运载及缓释,利用MRI评估诊疗的结果,这一部分内容将在后面详细阐述.
2.3 胶束作为CEST造影剂的载体
CEST由Balaban等[51]于2001年首先提出,是一种相对较新的MRI方法.关于CEST技术,比较经典的原理解释是两池模型,包括自由水池(溶液池)与可交换池(溶质池).通过对可交换池预先施加饱和射频脉冲(RF),使可交换池中的质子得到饱和,进而与周围的自由水池中的质子进行化学交换,使水的磁共振信号降低,而通过测定水分子信号的变化,便可以间接获得大分子的浓度等信息.由于大分子溶质的浓度一般较小(mmol·L-1或μmol·L-1量级),因而不容易在常规磁共振图像上观察到信号,而不间断的饱和转移实际上起到了放大的作用,使得低浓度的溶质的相关信息可以被检测到.实现CEST的一个必要条件是溶质与溶液之间的固有频率差值(ΔCS)应该大于(或等于)化学交换的速率(K),即K≤ΔCS.近年来,已有文献报道了各种使CEST信号进一步增强的方法和体系.按照Bloch方程的理论推算[52, 53],可以通过提高结合水的保留时间,或改变自由水交换速率及交换方式来提高CEST灵敏度.由此衍生出多种CEST造影剂,例如:依靠顺磁性金属(如铕、镱、铥等)的化学位移诱导作用产生远距离交换位点,从而提高结合水的保留时间的顺磁化学交换饱和转移(PARACEST)造影剂;利用生物体内本身存在的带有可交换基团(如-NH2、-OH、-COOH等)的抗磁性分子(如多糖、多肽等)的抗磁性化学交换饱和转移(DIACEST)造影剂;一些新型的以两亲性的磷脂作为载体的脂质体基化学交换饱和转移(LIPOCEST)造影剂.
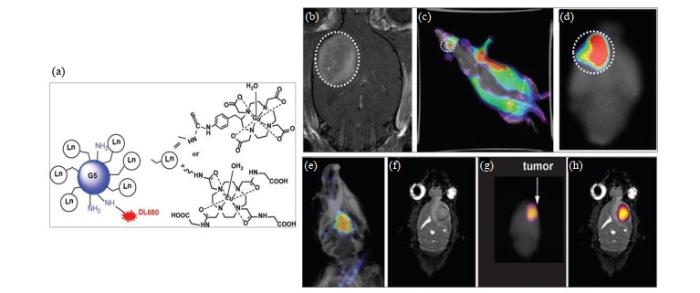
基于CEST造影剂依靠化学交换这一特点,有报道利用一些新型纳米材料本身的特性与CEST方法相结合,从而获得新的CEST效应.Castelli等[54]合成了具有十六烷基链的新型HPDO3A基配体及其Eu3+、Gd3+和Yb3+配合物.这些两亲顺磁性复合物可以在磷酸盐缓冲液和人血清中形成稳定存在的胶束.胶束中存在大量的镧系复合物(约200个分子),用于MRI检测时,也具有较高的灵敏度(胶束浓度为μmol·L-1);此外,在配合物中添加DSPE-PEG2000可以降低胶束的细胞毒性.作者详细研究了胶束的弛豫特性和CEST特性:装载有Eu-和Yb-HPDO3A复合物的胶束可充当pH传感器,用于CEST多色实验.树枝状聚合物也为开发基于纳米颗粒的药物递送系统和成像提供了模板.相比其他颗粒,树枝状大分子因具有较小尺寸(7~12 nm)的相对优势,可以改善肿瘤渗透效应,并增强肿瘤特异性药物的释放效果.PARACEST造影剂、Eu-DOTA-Gly4或临床使用的Gd-DOTA还可以共轭在G5 PAMAM树枝状聚合物的表面上.Ali等[55]为了创建MRI、光学成像双模态纳米颗粒,将Dylight680(DL680)加入到G5树枝状聚合物的胺表面.如图 4所示,在神经胶质瘤动物模型中使用MRI在脑部检测到该颗粒,体内和体外光学成像也验证了无创成像结果.
图4
图4
G5树枝状大分子的结构及在胶质瘤动物模型中的检测.(a) Dylight680(DL680)与Gd-DOTA或Eu-DOTA-Gly4装载到G5树枝状聚合物结构中.(b) Gd-G5-DL680,注射剂量为0.03 mmol Gd/kg.分别在白光和过滤激发下获得体内光学图像,发射滤光片设置为750 nm,用来分辨神经胶质瘤中的荧光.(c)大鼠脑的离体荧光成像清楚地显示Gd-G5-DL680在肿瘤内的选择性积累.(d)肿瘤以白色虚线圆圈表示.(e)覆盖在X射线图像上的大鼠头部的体内荧光图像显示脑中U87肿瘤中存在Eu-DOTA-Gly4-G5-DL680纳米颗粒.(f)冠状位磁共振图像显示U87肿瘤的位置.(g)全脑的离体荧光图像也检测到大脑中的纳米颗粒.(h)离体荧光图像叠加在磁共振图像上,以显示纳米颗粒位于U87神经胶质瘤中[55]
Fig.4
The structure of G5 dendrimer and detection in animal model of glioma. (a) Dylight680 (DL680) was conjugated with Gd-DOTA or Eu-DOTA-Gly4 preloaded G5 dendrimer. (b) The agent was Gd-G5-DL680 and injected at a dose of 0.03 mmol Gd/kg. In vivo optical image obtained under simultaneous white light and filtered excitation detected with the emission filter set at 750 nm demonstrating fluorescence in the glioma. (c) Ex vivo fluorescence imaging of rat brain clearly shows the selective accumulation of the Gd-G5-DL680 within the tumor. (d) Tumor is indicated as dotted white circle. (e) The in vivo fluorescent image of the rat head overlayed on an X-ray image shows the presence of Eu-DOTA-Gly4-G5-DL680 nanoparticle in the U87 tumor in the brain. (f) The coronal MR image shows the location of the U87 tumor. (g) The ex vivo fluorescence image of whole brain also detected the nanoparticle in the brain. (h) The ex vivo fluorescence image was also overlayed on the MR image to show that the nanoparticle was located in the U87 glioma[55]
图5
图5
使用CEST监测PEG-b-PDPA聚合物的pH响应行为.(A)嵌段共聚物PEG114-b-PDPA116中的胶束-单体平衡对pH非常敏感. (B) (a) PEG-b-PDPA在pH 5.0和7.5时的CEST谱;(b)在pH 5.0到7.5范围内,不对称磁化转移率(MTRasym)与饱和频率偏移的关系图;(c) MTRasym与pH的关系;(d) pH 5.8时,MTRasym与PEG-b-PDPA共聚物浓度的关系[56]
Fig.5
The use of CEST for monitoring the pH-responsive behaviors of PEG-b-PDPA polymers. (A) The micelle-unimer equilibrium in the block copolymer, PEG114-b-PDPA116, is exquisitely sensitive to pH. (B) (a) Representative CEST spectra of PEG-b-PDPA at pH 5.0 and 7.5, respectively; (b) A plot of MTRasym versus the saturation frequency offset at the pH range between 5.0 and 7.5; (c) A plot of MTRasym versus pH; (d) A plot of MTRasym versus PEG-b-PDPA copolymer concentration at a fixed pH of 5.8[56]
越来越多的证据表明,纳米颗粒药物递送系统(nano-DDS)在提高递送效率和减少脱靶不良反应等方面拥有巨大的应用前景.通过跟踪药物递送和分布、监测纳米颗粒降解和药物释放、帮助和优化治疗计划,以及指导更强大的纳米DDS的设计,图像引导已成为纳米医学的重要组成部分.CEST成像也可用于实现基于图像引导的药物递送,它能够以高空间分辨率的方式对众多的生物有机物、天然化合物甚至纳米载体进行检测.目前,CEST MRI已成为一种多功能的成像技术,用于在体内对纳米颗粒及其负载药物进行无创追踪[57].
2.4 其他胶束型磁共振造影剂
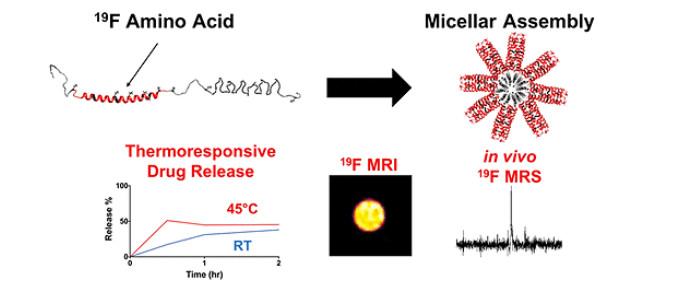
上面介绍的基于T1、T2及CEST的胶束型磁共振造影剂都是利用水中质子的信号,在生物体内受到较多背景信号的干扰.聚合物胶束作为磁共振造影剂的载体在一些异核(如19F、129Xe)成像上也有较多的应用.Montclare等[58]介绍了一种蛋白质嵌段共聚物的生物合成,称为“氟化热响应组装蛋白”(F-TRAP),它可组装成单分散纳米级胶束,该胶束具有有趣的19F NMR特性以及小分子封装和释放治疗的能力,可以作为诊断和治疗试剂.如图 6所示,F-TRAP胶束由卷曲螺旋五聚体外冕层和疏水性、热响应性弹性蛋白样多肽核心组装而成,组装后氟化蛋白的自旋-自旋弛豫时间(T2)显著降低,但自旋-晶格弛豫时间(T1)几乎不受影响.作者使用19F NMR初步探索了F-TRAP应用于活体磁共振的潜力.由于其固有的刺激响应特性,这种氟化胶束还拥有封装小分子化疗药物DOX并以热响应方式释放的能力,为开发热响应性19F MRI/MRS可追溯治疗诊断试剂提供了一条新途径.
图6
Whittaker等[59]在含氟丙烯酰胺类单体中加入高亲水性亚砜基团,使含氟聚合物具备了优异的水溶性,并表现出作为19F MRI造影剂的优异的成像灵敏度,这为其进一步在体内的应用开辟了新的可能性.作者以牛血清白蛋白(BSA)为模型治疗分子,通过光聚合技术介导的接枝方法,成功地合成了蛋白质-氟聚合物偶联物.由于偶联条件温和,该偶联物保持了良好的酯酶活性.并且,药代动力学研究表明,氟聚合物的偶联可显著延长BSA在血液中的循环时间.此外,该偶联物可用于活体19F MRI检测,并且具有极高的灵敏度,这使得定量检测偶联物的生物分布和代谢等信息得以实现,进一步突显了使用含氟聚合物结合蛋白质优于其他聚合物的好处.这项工作中开发的氟聚合物是对目前生物偶联方法的重要补充,为下一代可自我跟踪的治疗性聚合物偶联物的开发提供了新思路.
3 环境响应型胶束在肿瘤组织MRI检测中的应用
环境响应型胶束是药物递送系统中的一个重要组成部分,通常指一类能够根据其所处的环境做出特定响应的药物载体.这里的环境条件既包括温度、压力、电位、pH、氧化还原等物理化学环境,也包括酶、激素、细胞因子等生化环境.而响应则包括降解、组装、释药、活化、粘附、蓄积等行为.环境响应型载体至少包括两个功能组件:其一是响应组件,用于感知并对外界环境做出响应;二是载药组件,用于搭载药物或造影剂,实现特定的生理功能,但有时这两部分可以合二为一.表 2总结了一些具有环境响应性的聚合物单体基团.由于聚合物胶束在水溶液中常常形成星状、球状或是棒状的形态,当条件改变时,含有这些基团的聚合物胶束会在其作用下发生形态、大小(粒径)的改变,甚至是瓦解.环境响应型胶束长期以来作为药物运载和缓释的载体,利用的正是其胶束中亲水或疏水基团形态的改变.基于这种特性,也可以设计一系列受到环境条件改变而产生造影效果由“ON”到“OFF”或者由“OFF”到“ON”的造影剂.
表2 一些主要的环境敏感性的重复单元结构及环境响应类型
Table 2
| 聚合物名称 | 重复单元结构 | 类型 | 响应范围 |
| 聚(N-乙烯基吡啶) Poly(N-vinyl pyridine) |  | pH敏感型 | pH:3~5 |
| 聚(丙烯酸) Poly(Acrylic acid) | 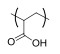 | pH敏感型 | pH:5~7 |
| 葡聚糖Dextran |  | pH敏感型 | pH:3~5 |
| 聚(L-天冬氨酸) Poly(L-aspartic acid) | 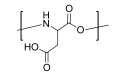 | pH敏感型 | pH:6~8 |
| 聚(L-组氨酸) Poly(L-histidine) |  | pH敏感型 | pH:5~7 |
| 聚己内酯Poly(ε-carprolactone) | 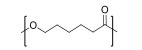 | pH及温度敏感型 | pH:5~7 T:35~40 ℃ |
| 聚(异丙基丙烯酰胺)Poly(Isopropyl-acrylamide) |  | 温度敏感型 | T:35~40 ℃ |
| 聚(丙交酯-共-乙交酯)Poly(Lacide-co-glycolide) | 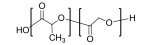 | 温度敏感型 | T:30~40 ℃ |
3.1 pH敏感型胶束在肿瘤组织MRI检测中的应用
肿瘤细胞长期进行无氧呼吸,缺乏有氧糖酵解作用,因此其病变组织的pH与正常组织有所不同,偏酸性.当pH敏感型胶束在肿瘤组织周边聚集时,其形态会因为pH环境的变化而发生改变,因此可以广泛应用于肿瘤等疾病的早期检测.2019年,Wang等[60]合成了一种两亲性嵌段共聚物——聚(乙二醇)-b-聚(β-苄基L-天冬氨酸)(mPEG-PBLA),其PBLA接枝不同摩尔比的N, N-二异丙基氨基乙胺氨基化(DIP)和N, N-二丁氨基乙胺(DBA).作者筛选出具有适当pKa的共聚物mPEG-PAsp(DBA 75% & DIP 25%)制备pH敏感型胶束,该胶束可以封装高含量的疏水性抗癌药物DOX和SPIO,在中性pH值下处于稳定状态,但在弱酸性条件下会快速分解.胶束纳米药物能被肝癌细胞(HepG2)有效吸收,并且在酸性溶酶体隔室内很容易触发DOX释放,从而使药物游离并迁移到细胞核.体内荧光成像和MRI实验表明,具有合适大小和弱正电荷的PEG化纳米药物可以在血液中停留更长时间,并优先渗入肿瘤.该纳米药物不仅对HepG2细胞表现出高细胞毒性,而且显著延长了荷瘤小鼠的存活时间,从而证明了这种pH敏感且MRI可视化的胶束在治疗癌症方面的巨大潜力.
朱康顺等[61]合成了包含索拉非尼(SF)、SPIO和叶酸(FA)修饰的pH敏感型纳米胶束,并利用体外MRI实验研究其对原发性肝细胞癌(HCC)的抗癌功效.具体操作是首先制备了FA、PEG、N, N-二丁基乙二胺和N, N-二异丙基乙二胺接枝聚L-天冬氨酸的共聚物FA-PEG-PAsp(DBA/DIP),然后将SF和SPIO封装在共聚物内,以合成靶向胶束FA-PEG-PAsp(DBA/DIP)-SPIO/SF(FPASS).另外,以非靶向的无叶酸胶束PEG-PAsp(DBA/DIP)-SPIO/SF(PASS)作为对照,分析了胶束的理化性质和药物释放行为.对使用具有不同Fe浓度的FPASS和PASS孵育的HepG2细胞进行MRI实验,并对使用胶束(Fe浓度为20 μg/mL)处理的细胞进行普鲁士蓝染色,以评估胶束的药物递送和成像能力.HepG2细胞在与FPASS孵育之前用过量的游离FA进行预处理,随后进行细胞活力、细胞凋亡、细胞周期和管形成测定,以评价胶束的抗HCC作用.实验结果证明这种胶束具有对pH敏感的MRI可视化功能和SF递送能力,有助于提高抗HCC作用.Cheng等[62]则合成了另一种pH敏感型共聚物—2-(二异丙基氨基)乙胺接枝聚(L-天冬氨酸)和2-巯基乙胺接枝聚(L-天冬氨酸)的二嵌段共聚物(PAsp(DIP)-b-PAsp(MEA),PDPM),该二嵌段共聚物能自组装成胶束,负载化疗药物DOX,并引入用于光热化疗和光声成像的金纳米笼结构.如图 7所示,用PEG进一步表面改性后,负载DOX的pH敏感金纳米笼(D-PGNC)粒径在100 nm左右,且具有均匀的球形结构,其中PAsp(DIP)的pH敏感核心结合了DOX,夹层通过二硫键交联并装饰有不连续的金壳和PEG外冕层.由于夹层的交联和金纳米笼的装饰,D-PGNC中DOX在血液中的释放被关闭,但在肿瘤组织内部通过多种刺激被打开,刺激包括肿瘤组织的低pH值(~6.8)、癌细胞溶酶体低pH值(~5.0)和近红外(NIR)的照射.受NIR照射的金纳米笼可以用于热疗来消融肿瘤细胞.此外,肿瘤组织内DOX荧光和光声成像的分析表明,基于金纳米笼的光热疗法能有效推动DOX在肿瘤内部的渗透.由于有利于杀死癌细胞的药物在肿瘤内快速释放,并且深入渗透组织,基于D-PGNC和NIR照射的协同治疗表现出优于单独化疗或NIR诱导光热治疗的效果.
图7
3.2 温度敏感型胶束在肿瘤组织MRI检测中的应用
同pH敏感型胶束一样,利用一些具有温敏型链段的胶束也可以对肿瘤病变组织进行检测.一些具有低临界相转变温度(LCST)的温度敏感型聚合物胶束的粒径会随着温度而变化,从而对周边产生MRI信号的质子所处的环境产生影响.Gao课题组[63]报告了一种基于氟化离子液体的可激活19F MRI平台,用于开发智能19F探针.如图 8所示,作者选择了几种具有合适熔点的氟化离子液体,并将它们稳定地限制在中空介孔二氧化硅(HMS)球体中,然后用刺激响应共聚物密封孔隙密封,导致19F信号“关闭”.在被热刺激激活后,一个“开启”的19F信号会点亮没有背景信号干扰的活体目标区域.这项工作极大地促进了温度刺激响应型19F探针的开发,对基于19F MRI的疾病诊断非常重要.
图8
3.3 其他响应型胶束在肿瘤组织MRI检测中的应用
除了利用生理组织中pH和温度等特性外,一些具有其他刺激(如光、磁场等)响应作用的基团也被应用于磁共振造影剂的制备.Jiang等[64]构建了基于聚-(N-ε-羧苄氧基-l-赖氨酸)(PZLL)接枝透明质酸(HA)共聚物的氧化还原反应型纳米粒子(HA-g-SS-PZLL)用于肝细胞癌的诊断和治疗.这些低浓度HA衍生物在水溶液中自组装形成纳米颗粒.与正常生理环境下的缓慢DOX释放相比,氧化还原触发释放DOX速率更快.体外T2 MRI结果表明,HA-g-SS-PZLL的r2弛豫率约为231 mM-1·s-1,并增强了磁共振图像的对比度.最后,作者使用HA-g-SS-PZLL对HepG2荷瘤BALB/c小鼠进行活体MRI实验,结果显示了该纳米颗粒应用于活体成像和治疗的潜力.除此之外,还有一些研究利用对特定部位施加外磁场或者光作用来产生含有造影剂的胶束的形态变化,进而达到靶向性的磁共振造影效果.Hu和Xing等[65]利用不同疏水链段上重复的二硒键,合成了三种富二硒醚的两嵌段共聚物.如图 9所示,疏水基团中含有刚性苯基的疏水结构有利于自组装的可控性和高载药量.作者首次实现了可见光诱导的核交联,其中二硒键作为交联部分,表现出氧化还原响应降解的特征.将高含量的环磷酰胺(CPT)和DOX药物包埋在纳米载体中,形成双核交联型药物胶束CPT/DOX-CCM.在肿瘤相关的氧化还原微环境中,CPT和DOX的药物释放受到控制.富二硒醚纳米载体具有载药量高、可见光诱导原位交联、改善生理稳定性、优化药代动力学、肿瘤特异性联合释药等多种特性,在多种药物、造影剂的释放,以及对耐药肿瘤的抑制等方面具有广阔的应用前景.
图9
总的来说,环境响应型胶束具有一定的物理靶向性,对于特定组织和部位的造影,该类胶束型造影剂的稳定性和对比效果相比普通造影剂都有所提高,通过对共聚物胶束进行一些表面修饰,可以较容易地实现多种靶向性.
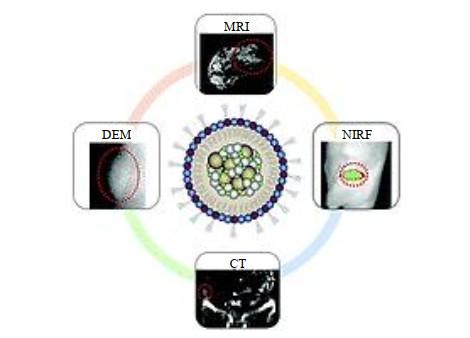
4 基于聚合物胶束的多模态分子探针设计
当前,仅基于一种影像方法的检测及诊断往往过于单一,缺乏完整的组织、结构和分子信息.引入不同的成像方法,结合各种探针的优点进行多模态靶向分子探针的构筑是有效提高微小肿瘤早期诊断准确率的关键.而聚合物胶束本身具有两亲性结构,且在水溶液体系中大多以外壳内核结构的形式存在,通过对亲水端或疏水端进行功能化的改造,能更方便地引入其他官能团,可很好的提高多模态分子探针的灵敏度.
图10
Kataoka等[67]设计并合成了聚(乙二醇)-b-聚(γ-苄基L-谷氨酸)与螯合剂DOTA相连的新型嵌段共聚物(DOTA-PEG-b-PBLG).如图 11所示,作者成功制备了直径为30 nm的DOTA功能化聚合物胶束(DOTA/m),该尺寸有助于DOTA/m深入渗透到具有厚纤维化的肿瘤,包括硬胃癌(SGC).111In标记的DOTA/m在Colon-26肿瘤(具有高渗透性的小鼠结肠癌)以及OCUM-2 MLN肿瘤(具有低渗透性的SGC)中高度积累,单光子发射计算机断层扫描(SPECT)清楚地描绘了两种肿瘤区域.Gd标记的DOTA/m与高空间分辨率的MRI结合,清楚显示了OCUM-2 MLN肿瘤区域.此外,111In/Gd标记的胶束,以及111In和Gd标记的DOTA/m混合物证明了该系统对SCG的SPECT/MRI多模态成像的能力.
图11
Wang等[68]则将脱镁叶绿素(Pheo)分散到Pluronic F127中,并用低温表面活性剂汽提法去除多余的表面活性剂.与其他两种同样具有高卟啉浓度的纳米材料相比,表面活性剂剥离的Pheo胶束(ss-Pheo)具有相似的尺寸,但具有更强的NIRF效果.ss-Pheo产生的单线态氧更多,使PDT成为可能.ss-Pheo同时具备较高的光声和荧光成像对比度,在用64Cu无缝标记后还用于正电子发射断层扫描(PET),作者在原位乳腺肿瘤模型小鼠中实现了上述3种成像模式.
5 总结与展望
MRI作为一种无侵入性、无放射性的临床影像学方法,在癌症的早期诊断方面具有广泛的应用前景.通常情况下,传统1H MRI的检测灵敏度为毫摩尔量级[69],这不利于对肿瘤等病变组织微环境及其在细胞水平和分子水平的检测.因此,发展新型磁共振方法、设计更加合适的分子探针,对于提高MRI的检测灵敏度显得十分重要.两亲型共聚物胶束因其本身所具有的亲疏水结构、粒径合适、稳定性好、易于功能化等优点,可以很好的用作MRI造影剂的载体,或者直接进行造影.例如:对比传统的小分子造影剂,胶束体系的造影剂具有更高的弛豫率以及稳定性;与脂质体相比,则具有更长的血液循环时间.而通过改进共聚物胶束的结构,获得基于T1、T2、CEST和其他方式的磁共振造影新方法,为磁共振造影剂的研发、提高MRI灵敏度开拓了新的思路.
聚合物胶束作为MRI造影剂载体的应用已经被广泛开展,其在不同的应用中具有不同的作用.聚合物胶束单纯地作为造影剂的载体,一方面是其能够提高造影剂的负载量进而提高灵敏度,另一方面也能够提高造影剂本身的弛豫效率,这些对于评估胶束体系所起的作用具有重要的参考价值.利用肿瘤微环境中的特殊性质,例如微酸、缺氧、过表达某些物质和EPR效应等,设计针对某种特性响应的胶束体系,如pH响应、谷胱甘肽(GSH)响应和酶响应等,能够对感兴趣区域进行靶向识别,进一步提高成像对比度.胶束作为多模态造影剂的载体则是多种成像模式的融合以及创新,结合2种或2种以上的成像方式,可为肿瘤的识别和诊断提供更加丰富的结构和功能信息.
当前,将共聚物胶束特别是环境响应型胶束应用到造影剂制备的研究虽然丰富,但还有许多问题亟待解决,譬如生物安全性和体内的结构稳定性等的研究还不够深入.另外,通过将胶束的特性与一些磁共振新方法进行结合,寻找更加合适的胶束体系,以提高MRI分子探针的灵敏度;或者通过引入多模态分子探针,弥补磁共振方法的不足,都将是未来聚合物胶束作为生物医用材料的主要研究方向.
今后,胶束型磁共振造影剂体系的发展可以是多方面、多途径的.例如通过改进胶束体系进一步提高小分子磁共振造影剂体系的弛豫效率,弥补传统1H MRI造影剂的不足;对于异核磁共振造影剂,特别是19F MRI来说,胶束体系可以极大提高体系的19F含量,对比小分子19F造影剂则可以成量级的提高其灵敏度.最后,利用肿瘤微环境的特性,针对性的研究响应型的聚合物胶束体系,提高成像对比度,是早发现、早诊断肿瘤,甚至攻克肿瘤至关重要的一步.
无
参考文献
Molecular imaging
[J].DOI:10.1148/radiology.219.2.r01ma19316 [本文引用: 1]
Watersoluble polymers in medicine
[J].
ICG-conjugated and 125I-labeled polymeric micelles with high biosafety for multimodality imaging-guided photothermal therapy of tumors
[J].DOI:10.1002/adhm.201901616 [本文引用: 1]
Poly(glycerol) used for constructing mixed polymeric micelles as T1 MRI contrast agent for tumor-targeted imaging
[J].DOI:10.1021/acs.biomac.6b01437 [本文引用: 1]
A novel polymeric micelle used for in vivo MR imaging tracking of neural stem cells in acute ischemic stroke
[J].DOI:10.1039/C7RA00345E [本文引用: 1]
Biodegradable catalase-modified micelles as ultrasound contrast agents for inflammation detection
[J].DOI:10.1002/ppsc.202000193 [本文引用: 1]
Mixed micelles of lipoic acid-chitosan-poly (ethylene glycol) and distearoylphosphatidylethanolamine-poly (ethylene glycol) for tumor delivery
[J].DOI:10.1016/j.ejps.2017.02.001 [本文引用: 1]
Polymeric micelles in cancer immunotherapy
[J].
Macrophage escape by cholesterol-polyoxyethylene sorbitol oleate micelles for pulmonary delivery
[J].DOI:10.2217/nnm-2019-0376 [本文引用: 1]
Mechanisms of drug release in pH-sensitive micelles for tumour targeted drug delivery system: A review
[J].
Folate-targeted polymeric micelles loaded with ultrasmall superparamagnetic iron oxide: combined small size and high MRI sensitivity
[J].
A dual ligand targeted nanoprobe with high MRI sensitivity for diagnosis of breast cancer
[J].
Folate‑targeted polymeric micelles loaded with superparamagnetic iron oxide as a contrast agent for magnetic resonance imaging of a human tongue cancer cell line
[J].
Polymeric hybrid nanomicelles for cancer theranostics: an efficient and precise anticancer strategy for the codelivery of doxorubicin/miR-34a and magnetic resonance imaging
[J].
Protoporphyrin IX (PpIX)-coated superparamagnetic iron oxide nanoparticle (SPION) nanoclusters for magnetic resonance imaging and photodynamic therapy
[J].
Size and PEG length-controlled PEGylated monocrystalline superparamagnetic iron oxide nanocomposite for MRI contrast agent
[J].
Synthesis and characterization of controlled drug release carriers based on functionalized amphiphilic block copolymers and super-paramagnetic iron oxide nanoparticles
[J].DOI:10.1002/pat.3697 [本文引用: 1]
Multi-stimuli-responsive magnetic assemblies as tunable releasing carriers
[J].DOI:10.1039/C5TB00845J [本文引用: 1]
Magnetically responsive hybrid nanoparticles for in vitro siRNA delivery to breast cancer cells
[J].DOI:10.1016/j.msec.2019.02.026
Advances in non-covalent crosslinked polymer micelles for biomedical applications
[J].
Biomolecule-assisted green synthesis of nanostructured calcium phosphates and their biomedical applications
[J].DOI:10.1039/C8CS00489G [本文引用: 1]
Theranostic polymeric micelles for the diagnosis and treatment of hepatocellular carcinoma
[J].DOI:10.1166/jbn.2015.1945 [本文引用: 1]
A new Gd-based T2-weighted magnetic resonance imaging contrast agent: Preparation and application in stem cell imaging
[J].
新型Gd基T2造影剂的制备和应用
[J].
Deposition of gadolinium onto the shell structure of micelles for integrated magnetic resonance imaging and robust drug delivery systems
[J].
Tumor-microenvironment relaxivity-changeable Gd-loaded poly (L-lysine)/carboxymethyl chitosan nanoparticles as cancer-recognizable magnetic resonance imaging contrast agents
[J].
Multifunctional pH-sensitive polymeric nanoparticles for theranostics evaluated experimentally in cancer
[J].
Nanoparticle-based systems for T1-weighted magnetic resonance imaging contrast agents
[J].DOI:10.3390/ijms140510591 [本文引用: 1]
A biocompatible gadolinium-based amino acid copolymer contrast agent for magnetic resonance imaging
[J].
氨基酸共聚物修饰的生物相容性MRI造影剂
[J].
Iron hydroxide nanoparticles coated with poly (ethylene glycol)-poly (aspartic acid) block copolymer as novel magnetic resonance contrast agents for in vivo cancer imaging
[J].DOI:10.1016/j.colsurfb.2006.12.019
Magnetic resonance imaging-visible and pH-sensitive polymeric micelles for tumor targeted drug delivery
[J].
Oligoethylenimine grafted PEGylated poly (aspartic acid) as a macromolecular contrast agent: properties and in vivo studies
[J].DOI:10.1039/C6TB00278A [本文引用: 1]
Diagnostic performance of MRI in the detection of renal lipid-poor angiomyolipomas: a systematic review and meta-analysis
[J].DOI:10.1148/radiol.2020192070 [本文引用: 1]
Carotid plaque lipid content and fibrous cap status predict systemic CV outcomes: the MRI substudy in AIM-HIGH
[J].DOI:10.1016/j.jcmg.2016.06.017 [本文引用: 1]
T2 mapping MRI technique quantifies carotid plaque lipid, and its depletion after statin initiation, following acute myocardial infarction
[J].DOI:10.1016/j.atherosclerosis.2018.08.033
Flexible water excitation for fat-free MRI at 3T using lipid insensitive binomial off-resonant RF excitation (LIBRE) pulses
[J].
The role of dynamic post-contrast T1-w MRI sequence to characterize lipid-rich and lipid-poor adrenal adenomas in comparison to non-adenoma lesions: preliminary results
[J].
Quantitative analysis of lipid-rich necrotic core in carotid atherosclerotic plaques by in vivo magnetic resonance imaging and clinical outcomes
[J].
T2-weighted magnetic resonance imaging of hepatic tumor guided by SPIO-loaded nanostructured lipid carriers and ferritin reporter genes
[J].
Addressing metabolic heterogeneity in clear cell renal cell carcinoma with quantitative Dixon MRI
[J].DOI:10.1172/jci.insight.94278 [本文引用: 1]
Characteristics of gadolinium-DTPA complex: a potential NMR contrast agent
[J].DOI:10.2214/ajr.142.3.619 [本文引用: 1]
PEG-poly (L-lysine)-based polymeric micelle MRI contrast agent: Feasibility study of a Gd-micelle contrast agent for MR lymphography
[J].DOI:10.1002/jmri.25740 [本文引用: 1]
Visual targeted therapy of hepatic cancer using homing peptide modified calcium phosphate nanoparticles loading doxorubicin guided by T1 weighted MRI
[J].DOI:10.1016/j.nano.2018.06.014 [本文引用: 1]
Preparation of Mn2+@PolyDOPA-b-polysarcosine micelle as MRI contrast agent with high longitudinal relaxivity
[J].DOI:10.1080/10601325.2020.1840918 [本文引用: 1]
Compact micellization: a strategy for ultrahigh T1 magnetic resonance contrast with gadolinium-based nanocrystals
[J].DOI:10.1021/acsnano.6b02559 [本文引用: 3]
Ultrasound-induced and MRI-monitored CuO nanoparticles release from micelle encapsulation
[J].
DOTA-branched organic frameworks as giant and potent metal chelators
[J].DOI:10.1021/jacs.9b09269 [本文引用: 1]
Superparamagnetic iron oxide based MRI contrast agents: Current status of clinical application
[J].
Dendrimer-and copolymer-based nanoparticles for magnetic resonance cancer theranostics
[J].DOI:10.7150/thno.27828 [本文引用: 3]
Cyclic RGD functionalized liposomes targeted to activated platelets for thrombosis dual-mode magnetic resonance imaging
[J].DOI:10.1039/C9TB01834D [本文引用: 1]
Dextran-benzoporphyrin derivative (BPD) coated superparamagnetic iron oxide nanoparticle (SPION) micelles for T2-weighted magnetic resonance imaging and photodynamic therapy
[J].DOI:10.1021/acs.bioconjchem.9b00676 [本文引用: 1]
A new class of contrast agents for MRI based on proton chemical exchange dependent saturation transfer (CEST)
[J].DOI:10.1006/jmre.1999.1956 [本文引用: 1]
Optimization of the irradiation power in chemical exchange dependent saturation transfer experiments
[J].DOI:10.1016/j.jmr.2005.04.005 [本文引用: 1]
Numerical solution of the Bloch equations provides insights into the optimum design of PARACEST agents for MRI
[J].
Development and characterization of lanthanide-HPDO3A-C16-based micelles as CEST-MRI contrast agents
[J].DOI:10.1039/C8DT04621B [本文引用: 1]
Application of dendrimer-based nanoparticles in glioma imaging
[J].
A novel class of polymeric pH-responsive MRI CEST agents
[J].DOI:10.1039/c3cc42452a [本文引用: 3]
CEST MRI trackable nanoparticle drug delivery systems
[J].DOI:10.1088/1748-605X/abdd70 [本文引用: 1]
Protein-engineered nanoscale micelles for dynamic 19F magnetic resonance and therapeutic drug delivery
[J].DOI:10.1021/acsnano.8b07481 [本文引用: 3]
Low-fouling fluoropolymers for bioconjugation and in vivo tracking
[J].DOI:10.1002/anie.201914119 [本文引用: 1]
MRI-visible and pH-sensitive micelles loaded with doxorubicin for hepatoma treatment
[J].DOI:10.1039/C8BM01501E [本文引用: 1]
MRI-visible and pH-sensitive nanomicelles for targeting delivery of sorafenib to hepatocellular carcinoma
[J].
MRI可视化pH敏感纳米胶束用于肝癌靶向输送索拉非尼的可行性
[J].
Gold nanocage decorated pH-sensitive micelle for highly effective photothermo-chemotherapy and photoacoustic imaging
[J].DOI:10.1016/j.actbio.2017.10.018 [本文引用: 3]
A fluorinated ionic liquid-based activatable 19F MRI platform detects biological targets
[J].DOI:10.1016/j.chempr.2020.01.023 [本文引用: 3]
Redox-responsive nanoparticles from disulfide bond-linked poly-(N-ε-carbobenzyloxy-L-lysine)- grafted hyaluronan copolymers as theranostic nanoparticles for tumor-targeted MRI and chemotherapy
[J].DOI:10.1016/j.ijbiomac.2020.01.071 [本文引用: 1]
Visible light-induced crosslinking and physiological stabilization of diselenide-rich nanoparticles for redox-responsive drug release and combination chemotherapy
[J].DOI:10.1016/j.biomaterials.2017.01.002 [本文引用: 3]
An all-in-one nanoparticle (AION) contrast agent for breast cancer screening with DEM-CT-MRI-NIRF imaging
[J].DOI:10.1039/C8NR03741H [本文引用: 3]
Polymeric micelle platform for multimodal tomographic imaging to detect scirrhous gastric cancer
[J].DOI:10.1021/acsbiomaterials.5b00142 [本文引用: 3]
Surfactant-stripped pheophytin micelles for multimodal tumor imaging and photodynamic therapy
[J].
Strategies for increasing the sensitivity of gadolinium-based MRI contrast agents
[J].DOI:10.1039/b510982p [本文引用: 1]