引言
磁共振成像(MRI)具有高的空间分辨率和深层的组织穿透能力,在疾病临床诊断方面享有独特的优势.然而,传统的质子MRI信号具有灵敏度低和背景干扰强等缺点[6, 7].为解决这一问题,伴随着自旋交换光泵技术[8-12]的发展,超极化129Xe MRI分子探针开始实用化.129Xe是一种无毒的惰性气体,可溶于血液,其化学位移对周围环境(pH、温度、酶等)非常敏感,这些特性使129Xe非常适合生物医学成像.129Xe可以在“分子笼”的帮助下与蛋白质、磷脂等相互作用.目前,一系列新的分子笼[13]已被开发.其中,穴番-A及其衍生物是最合适的129Xe结合分子笼[14],因为它们与129Xe的亲和力最佳.近年来,已开发出大量基于穴番-A的129Xe生物传感器,用于检测金属离子[15-17]、硫醇[18, 19]、pH[20, 21]、酶[22, 23]、硫化氢[24]、核酸[25]、跨膜受体靶标[26-30]、蛋白质[31-33]等.与传统的热极化相比,新的超极化129Xe技术可以使129Xe的极化增强10万倍以上,大大提高MRI信号的检测灵敏度.但是,超极化129Xe MRI探针的灵敏度仍然不足以支持体内相关分子的检测.为此,结合了超极化129Xe和化学交换饱和转移的Hyper-CEST技术被开发出来,以进一步提高129Xe分子探针的检测灵敏度.Hyper-CEST使用交换进出超分子笼的129Xe和施加的预饱和脉冲来减少在129Xe溶解状态下观察到的信号.
本文设计了一种新型的将高灵敏度的129Xe Hyper-CEST与特定刺激响应相结合的穴番-A功能化分子探针a,由129Xe核磁共振(NMR)报告基团的穴番分子笼和对Cat B特异性相应的酰胺键组成.Cat B已被证实在非小细胞肺癌中过表达[34],当探针与非小细胞肺癌A549相互作用时,酰胺键的断裂会导致其129Xe化学位移发生变化.结合Hyper-CEST技术,可为Cat B提供一种新颖的检测方法.
1 实验部分
1.1 试剂
Cat B、N, N-二异丙基乙胺(DIPEA)和三氟乙酸(TFA)购自西格玛奥德里奇(上海)贸易有限公司;N-Boc-溴乙胺、N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸(EDCI)、Val-Lys-PABA-PNP和L-半胱氨酸(L-Cys)购自阿拉丁生化技术有限公司;碳酸钾、丙酮、乙酸乙酯、正己烷、二氯甲烷、盐酸、碳酸氢钠、氯化钠、甲醇和EDTA-2Na购自国药集团化学试剂有限公司;Cat B抑制剂CA-074 Me购自MCE;穴番-A购自武汉利普尔森科技有限公司;人肺腺癌细胞系A549和人胚肺成纤维细胞系MRC-5获自中国科学院细胞库(中国上海).除非另有说明,否则所有试剂未经进一步纯化直接使用.
1.2 探针a的合成
化合物2的合成.将穴番-A(化合物1,50 mg,0.057 mmol)和N-Boc-溴乙胺(100 mg,0.476 mmol)溶于25 mL丙酮中.向溶液中加入碳酸钾(100 mg,0.725 mmol),在回流条件下反应12 h.使用旋转蒸发仪除去丙酮,并将乙酸乙酯和水加入到残余固体中.有机层用水洗涤3次,然后旋干.使用硅胶柱色谱法,利用V正己烷: V乙酸乙酯=1:1的洗脱液纯化粗产物,得到白色固体状的化合物2(47 mg,产率为80%).1H NMR谱图(500 MHz,CDCl3):δ 6.80~6.65(m,12H),4.59(m,6H),4.23~4.10(m,12H),4.03(m,1H),3.87(m,1H),3.83~3.75(m,15H),3.65(m,1H),3.40(m,7H),1.53(s,9H).高分辨质谱[HRMS,采用电喷雾离子源(ESI)]:[M+K]+质荷比(m/z)的计算值为1 062.404 2,实验值为1 062.404 9.
化合物3的合成.冰浴条件下,滴加VTFA: VCH2Cl2=1:1的混合溶液(20 mL)至47 mg化合物2.反应15 min后,将TFA和CH2Cl2通过旋蒸除去,得到化合物3(产率为93%).HRMS(ESI):[M-CF3COO]-的m/z计算值为924.395 9,实验值为924.408 3.
化合物4的合成.将中间体化合物3溶解在再蒸馏的CH2Cl2(25 mL)中,并加入0.5 mL DIPEA.搅拌10 min后,向溶液中添加Val-Lys-PABA-PNP二肽衍生物(40 mg,0.053 mmol),室温条件下,搅拌反应16 h.然后向溶液中加入20 mL CH2Cl2,依次用30 mL 0.1 mol/L HCl、饱和NaHCO3、饱和NaCl洗涤.干燥后,将残余物使用硅胶柱色谱纯化,洗脱剂溶剂为CH2Cl2: MeOH=20:1(V/ V),得到浅黄色固体,即化合物4(29 mg,产率为42%).
探针a的合成.冰浴条件下,将VTFA: VCH2Cl2=1:1的混合溶液滴加到化合物4中.反应15 min后,通过旋转蒸发仪除去TFA和CH2Cl2,得到探针a(25 mg,产率为85%).HRMS(ESI):[M+Na]+的m/z计算值为1 456.625 7,实验值为1 456.625 1.
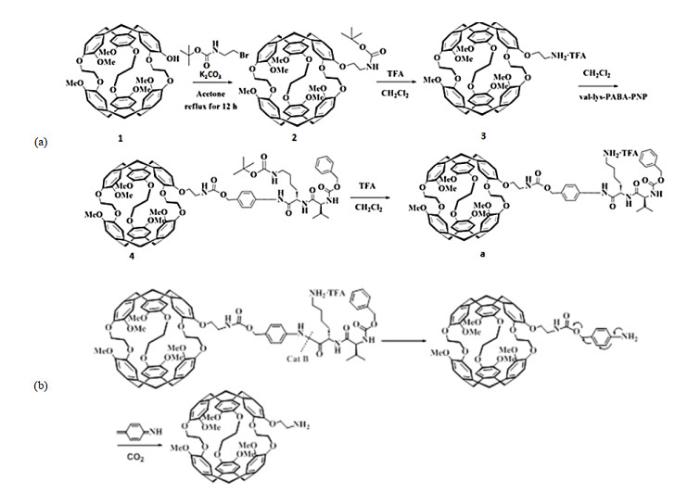
合成过程和反应机理如图 1所示.首先对穴番进行氨基衍生化,然后通过酰胺键将穴番与Z-Val-Lys的衍生物Val-Lys-PABA-PNP连接。该探针的酰胺键可被Cat B特异性酶切,随后进一步重排、离去生成穴番的氨基衍生物.
图1
图1
穴番探针a的(a)合成路线和(b)反应机理
Fig.1
(a) Synthetic route and (b) reaction mechanism of cryptophane biosensor a
1.3 溶液129Xe Hyper-CEST实验
向10 mmol/L乙酸钠的缓冲液(pH 5.0,含2 mmol/L EDTA-2Na、2 mmol/L L-Cys和0.1% DMSO)中加入不同浓度的探针a,配置成不同浓度的探针溶液,使用的Cat B含量为1 UN/mL,使用的Cat B抑制剂CA-074 Me浓度为10 μmol/L.
溶液129Xe Hyper-CEST测试在配备微成像梯度线圈的Bruker AV400宽口径波谱仪(Bruker Biospin,Ettlingen,Germany)上进行.Xe核的射频脉冲频率为110.7 MHz.具有90˚翻转角矩形脉冲的10 mm双谐振探头(129Xe和1H,PA BBO 400 W1/S2 BB-HD-10Z)用于采集129Xe NMR信号. 使用课题组自制超极化装置,通过自旋交换光泵法来制备超极化129Xe气体,129Xe核自旋极化度约为20%.
进行溶液129Xe Hyper-CEST实验时,将2 mL溶液样品装入10 mm NMR样品管中,通入由10% N2、88% He和2% Xe(86%富集的129Xe或天然丰度129Xe)组成的混合气体,持续20 s,然后等待3 s以确保产生的气泡完全破裂,再开始采集129Xe NMR信号.样品温度设定为300 K,由变温单元控制.δXe位于50~100 ppm之间,步长为5 ppm.饱和照射功率为6.5 μT,照射时间为10 s.
使用快速采集弛豫增强(RARE)序列采集磁共振图像,成像视野(FOV)=2×2 cm2、matrix size=32×32、slice thickness=30 mm、echo time=6 ms、repetition time=99.3 ms、rare factor=16.129Xe磁共振图像使用0.2*最大值作为阈值进行分割,然后插值到64×64矩阵中.
1.4 细胞129Xe Hyper-CEST实验
实验组样品制备:将A549细胞在25 cm2培养瓶中培养到大约90%的面积(5×106细胞).弃去培养基,用磷酸盐缓冲液(PBS)冲洗2次,加入2 mL含10 μmol/L(或其他浓度)探针a的MEM培养基(含1% DMSO);在培养箱中孵育6 h后,吸出培养基,用PBS冲洗3次细胞后,使用细胞刮刀将其收集在2 mL PBS中,以3 000 rpm离心2 min后,弃去上清液,将细胞分散在2 mL PBS中.
对照组A样品制备:其他条件与实验组相同,但在与探针a溶液(10 μmol/L)孵育前,将细胞用2 mL含50 μmol/L Cat B抑制剂CA-074 Me的MEM培养基(含1% DMSO)预处理1 h,并除去未吸收的CA-074 Me.然后进行后续实验.
对照组B样品制备:其他条件与实验组相同,但使用MRC-5细胞与含有10 μmol/L探针a的MEM培养基孵育.
空白组样品制备:其他条件与实验组相同,但未添加探针a溶液.
对上述样品进行细胞129Xe Hyper-CEST实验及磁共振图像采集,测试饱和照射功率为13 μT,其他方法及参数与溶液129Xe Hyper-CEST实验时相同.
1.5 细胞毒性检测实验
我们采用甲基四唑蓝(MTT)法检测探针a的细胞毒性,将A549细胞接种在96孔板中,细胞密度为5×104细胞/孔,培养过夜让细胞贴壁生长,弃去旧培养基,并添加200 μL设定浓度梯度(0、1、5、10、20、50、100 μmol/L)的探针a溶液(探针a溶于MEM培养基中,含1% DMSO),探针a终浓度以在490 nm波长下的吸光度确定.细胞与探针孵育4 h后,吸出培养基,用无菌PBS洗3遍;再加入新鲜全培养基,继续孵育44 h,接着加入MTT溶液至终浓度为0.5 mg/mL,继续孵育4 h;然后吸出培养基,加入200 μL DMSO,活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臜(Formazan)并沉积在细胞中,而死细胞不具备此功能.DMSO能溶解细胞中的结晶甲臜,将DMSO震荡均匀后,用酶联免疫检测仪在490 nm波长处测定其光吸收值,可间接反映活细胞数量.
2 结果与讨论
2.1 溶液129Xe Hyper-CEST研究
探针a是一个可以装载129Xe的分子笼,笼内的129Xe将与溶液中的129Xe发生交换.其结构中的酰胺键可被Cat B特异性剪切,导致分子笼的结构和性能发生变化.利用129Xe对化学环境的敏感性,获得超极化129Xe CEST信号,用于Cat B的超灵敏检测.
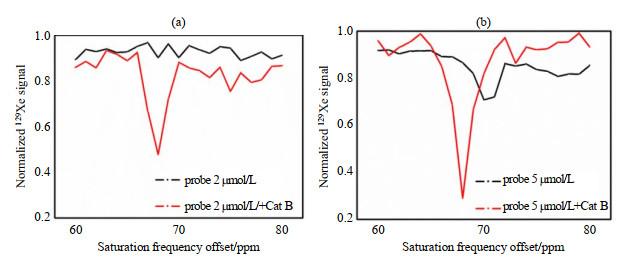
我们首先比较了探针a与Cat B反应前后(37 ℃,24 h)的Hyper-CEST信号,选择的饱和照射频率(RF)位点为60~80 ppm,每两点之间的间隔为1 ppm,并收集300 ppm的信号以对数据进行归一化.如图 2所示,浓度为2 μmol/L的探针a与Cat B反应前无CEST信号;与Cat B反应后,在68 ppm处出现非常明显的CEST信号.浓度为5 μmol/L的探针a反应前在70 ppm处具有相对较小的信号;反应后在68 ppm处具有非常明显的CEST信号.可以证明与Cat B反应前后,探针a的信号强度和化学位移存在差异,这表明它作为Cat B反应探针的可行性,并且CEST信号强度随探针浓度的增加而增加.
图2
图2
(a) 2 μmol/L和(b) 5 μmol/L的探针a与Cat B反应前后的129Xe Hyper-CEST信号
Fig.2
129Xe Hyper-CEST signals of probe a with concentrations of (a) 2 μmol/L and (b) 5μmol/L before and after reaction with Cat B
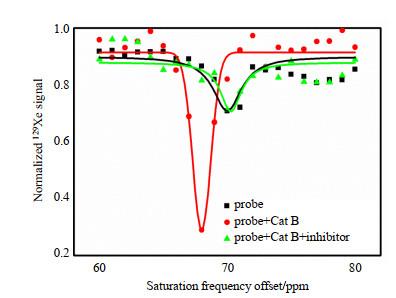
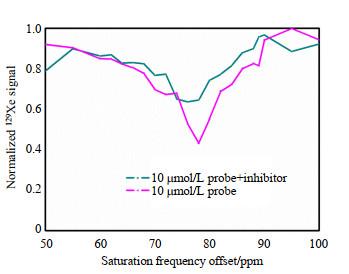
为验证该探针的特异性,我们添加了Cat B特异性抑制剂CA-074 Me,并保持溶液中其他成分浓度不变(探针a浓度为5 μmol/L).如图 3所示,加入抑制剂后的探针a和Cat B混合溶液的CEST信号与仅含探针a的溶液类似,而未加抑制剂的探针a和Cat B混合溶液在68 ppm处出现一个明显的CEST信号.这证明探针a对Cat B具有特异性响应,并且该响应可以被Cat B特异性抑制剂抑制.
图3
图3
抑制剂CA-074 Me对探针a和Cat B相互作用的影响
Fig.3
Effect of inhibitor CA-074 Me on reaction between Cat B and probe a
2.2 细胞129Xe Hyper-CEST研究
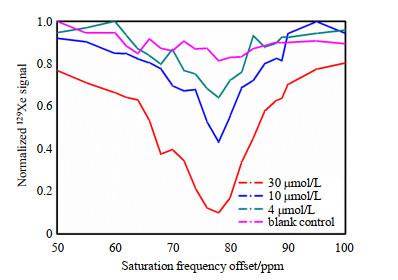
为了验证细胞水平下探针a对Cat B的响应,我们检测到探针a与A549细胞孵育后的Hyper-CEST信号位于78 ppm处(图 4),且CEST信号强度随探针a浓度的增加而增强.与溶液体系中探针a与Cat B反应后的信号出现在68 ppm不同,细胞体系中出现在78 ppm.这可能是因为复杂的细胞体系影响了129Xe在笼内笼外的交换速率,从而使得化学位移发生偏离.
图4
图4
不同浓度的探针a与A549细胞孵育后的Hyper-CEST信号
Fig.4
Hyper-CEST cellular signal of probe a with different concentrations after incubation with A549 cells
图5
图5
抑制剂CA-074 Me对探针a和A549细胞相互作用的影响
Fig.5
Effect of inhibitor CA-074 Me on reaction between A549 cell and probe a
图6
图6
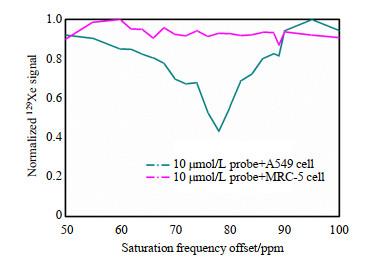
MRC-5与A549细胞分别与探针a孵育的Hyper-CEST信号
Fig.6
Hyper-CEST cellular signal of probe a incubation with A549 cell and MRC-5 cell
2.3 129Xe Hyper-CEST MRI效果
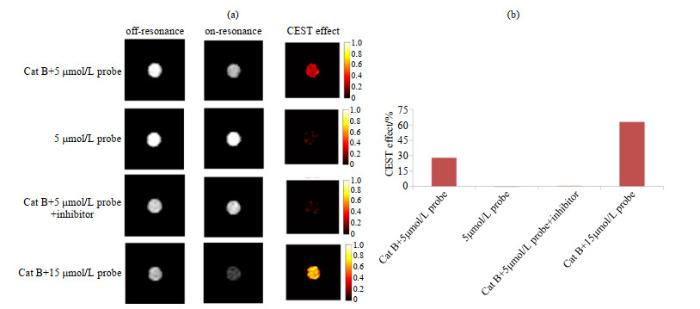
从图 7中可以看出,5 μmol/L探针a与低浓度的Cat B反应时,具有一定的Hyper-CEST成像效果(27.78%);当添加Cat B特异性抑制剂时,Hyper-CEST成像效果几乎消失,仅为0.5%;而空白溶液中没有此效果(-2.33%),这证明Hyper-CEST成像效果是由于探针a与Cat B的反应所致.将探针a的浓度增加至15 μmol/ L后,Hyper-CEST成像效果明显增强,达到62.98%.而且通过探针a和Cat B的反应,我们可以获得高对比度的图像.这证明我们设计的探针a可实现低浓度Cat B的Hyper-CEST成像.
图7
图7
(a) 溶液129Xe Hyper-CEST MRI和(b) CEST效果
Fig.7
(a) 129Xe Hyper-CEST imaging in solution and (b) CEST effect
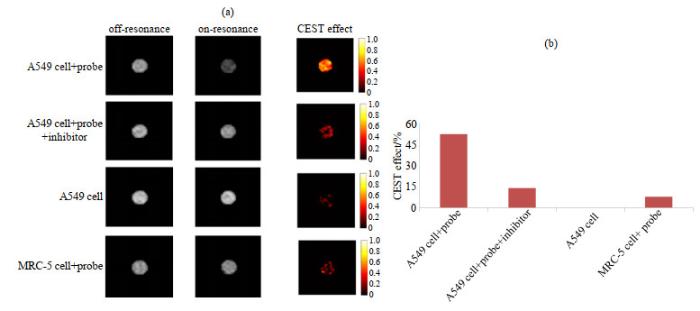
从图 8中可以看出,高浓度(25 μmol/L)探针a与A549细胞共孵育具有较好的Hyper-CEST成像效果,达到52.25%.当添加Cat B抑制剂时,成像效果显著降低至13.83%.没有探针(空白对照)的A549细胞没有CEST效应(-0.5%),这证明该效应源自探针a与A549细胞的反应.而探针a与MRC-5细胞孵育的Hyper-CEST成像效果也很差(7.76%),证实该探针具有特异性检测肺癌细胞的潜力.
图8
图8
(a) 细胞129Xe Hyper-CEST成像和(b) CEST效果
Fig.8
(a) Cellular 129Xe Hyper-CEST imaging and (b) CEST effect
2.4 探针a的细胞毒性检测
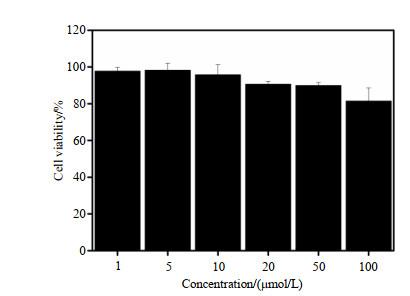
图 9显示了采用MTT法检测的探针a的细胞毒性,表明即使使用浓度高达100 μmol/L的探针a,A549细胞存活率仍可以大于80%,这证明该探针具有良好的生物相容性.前面实验使用的探针浓度最高为30 μmol/L,因此对A549细胞不会产生明显的细胞毒性,这证明该探针适用于MRI测试.
图9
图9
探针a对A549细胞的毒性测试
Fig.9
Viability test of A549 cells after incubation with probe a
3 结论
我们合成了一种新型的超灵敏的穴番衍生物129Xe探针,该探针由穴番和Cat B响应的二肽组成,并成功用于获得溶液和细胞的CEST NMR谱,而且灵敏度较高.与正常细胞相比,该探针a的CEST信号强度在与A549细胞孵育时显着增加,证明了其检测肺癌细胞的能力.我们还将该探针用于低浓度溶液和细胞的CEST成像,并获得了明显的成像对比效果,进一步证明了该探针可用于Cat B的超灵敏检测.
无
参考文献
Emerging roles of proteases in tumorsuppression
[J].
Plasma membrane association of cathepsin B in human prostate cancer: biochemical and immunogold electron microscopic analysis
[J].DOI:10.1002/pros.1132 [本文引用: 1]
Near-infrared optical imaging of protease activity for tumor detection
[J].DOI:10.1148/radiology.213.3.r99dc14866 [本文引用: 1]
Optical imaging with a Cathepsin B activated probe for the enhanced detection of esophageal adenocarcinoma by dual channel fluorescent upper GI endoscopy
[J].
Ultrasensitive chemiluminescent detection of cathepsin B: insights into the new frontier of chemiluminescent imaging
[J].DOI:10.1002/anie.201711228 [本文引用: 1]
Smart detection of toxic metal ions, Pb2+ and Cd2+, using a 129Xe NMR-based sensor
[J].DOI:10.1021/ac403669p [本文引用: 1]
Interactions between albumin and fatty acids studied by NMR spectroscopy
[J].
运用NMR研究白蛋白与脂肪酸的相互作用
[J].
Molecular sensing using hyperpolarized xenon NMR spectroscopy
[J].
Spin-exchange optical pumping of noble-gas nuclei
[J].
Production of hyperpolarized Xe-129 gas without nitrogen by optical pumping at Cs-133 D-2 line in flow system
[J].DOI:10.1088/0256-307X/21/8/024
Hyperpolarized xenon NMR and MRI signal amplification by gas extraction
[J].
Measuring polarization of hyperpolarized xenon-129 gas with low-field NMR
[J].
超极化气体氙-129的低场NMR测量
[J].
An expanded palette of xenon-129 NMR biosensors
[J].DOI:10.1021/acs.accounts.6b00309 [本文引用: 1]
A novel molecular cage for hyperpolarized 129Xe based on cucurbit [6] uril nanoparticles
[J].
新型葫芦[6]脲纳米颗粒超极化129Xe"分子笼"研究
[J].
Smart detection of toxic metal ions, Pb2+and Cd2+, using a Xe-129 NMR-based sensor
[J].DOI:10.1021/ac403669p [本文引用: 1]
Rational design of hyperpolarized xenon NMR molecular sensor for the selective and sensitive determination of zinc ions
[J].DOI:10.1016/j.talanta.2014.01.023
A molecular imaging approach to mercury sensing based on hyperpolarized Xe-129 molecular clamp probe
[J].DOI:10.1002/chem.201600193 [本文引用: 1]
Biothiol xenon MRI sensor based on thiol-addition reaction
[J].DOI:10.1021/acs.analchem.6b00403 [本文引用: 1]
Mitochondria targeted and intracellular biothiol triggered hyperpolarized 129Xe magnetofluorescent biosensor
[J].DOI:10.1021/acs.analchem.6b03742 [本文引用: 1]
Effect of pH and counterions on the encapsulation properties of xenon in water-soluble cryptophanes
[J].
A "smart" Xe-129 NMR biosensor for pH-dependent cell labeling
[J].DOI:10.1021/jacs.5b01938 [本文引用: 1]
Designing Xe-129 NMR biosensors for matrix metalloproteinase detection
[J].DOI:10.1021/ja0640501 [本文引用: 1]
Cryptophane xenon-129 nuclear magnetic resonance biosensors targeting human carbonic anhydrase
[J].DOI:10.1021/ja806092w [本文引用: 1]
Hyperpolarized Xe-129 magnetic resonance imaging sensor for H2S
[J].DOI:10.1002/chem.201605768 [本文引用: 1]
A cryptophane biosensor for the detection of specific nucleotide targets through xenon NMR spectroscopy
[J].DOI:10.1002/cphc.200700384 [本文引用: 1]
Cryptophane-folate biosensor for Xe-129 NMR
[J].DOI:10.1021/bc5005526 [本文引用: 1]
Molecular imaging of cancer cells using a bacteriophage-based 129Xe NMR biosensor
[J].
Design and characterization of two bifunctional cryptophane A-based host molecules for xenon magnetic resonance imaging applications
[J].
Live-cell MRI with xenon Hyper-CEST biosensors targeted to metabolically labeled cell-surface glycans
[J].
Development of an antibody-based, modular biosensor for Xe-129 NMR molecular imaging of cells at nanomolar concentrations
[J].DOI:10.1073/pnas.1406797111 [本文引用: 1]
A xenon-129 biosensor for monitoring MHC-peptide interactions
[J].DOI:10.1002/anie.200806149 [本文引用: 1]
Cell uptake of a biosensor detected by hyperpolarized Xe-129 NMR: The transferrin case
[J].
A doubly responsive probe for the detection of Cys4-tagged proteins
[J].DOI:10.1039/C5CC04721H [本文引用: 1]
Cathepsin B mediates caspase-independent cell death induced by microtubule stabilizing agents in non-small cell lung cancer cells
[J].DOI:10.1158/0008-5472.CAN-03-3060 [本文引用: 1]