引言
温度是所有生命活动的关键调控因素之一,它能够影响基因表达、蛋白质结构、蛋白质之间相互作用等[1-5].因此,准确测定生物体内外的温度,对于生物分子化学特性和功能的研究具有重要的意义.细胞作为生命有机体的基础,由多个不同功能的单元组成,而正因为不同单元的功能各异,因此细胞中不同区域的温度也存在差异[2, 3, 6].例如,全身性炎症通常伴有体温变化,表现为发烧或体温过低.这种体温变化会直接影响细胞内生物分子的活性[7, 8].ATP在线粒体内通过氧化还原呼吸链生成,而在此过程中产生的能量约有1/3以热量方式消耗,因此线粒体的内部温度能够超过50 ℃[9-11].目前,主流的分子温度传感器的开发主要依托于温度敏感的荧光蛋白质和人工化合物,通过光学检测来反推温度[12, 13].而在基于核磁共振(NMR)检测的温度传感器方面,主要以RNA为检测对象来进行温度测定[14].由此可见,分子温度传感器还存在较大的发展空间,而开发能够精确检测生物样品内外温度的传感器有助于加深对细胞功能本质的认识.
泛素(Ub)是一种广泛存在于真核细胞内的信号蛋白,它由5段β-片层与1段α-螺旋组成,具有稳定的三级结构[15, 16].Ser65被激酶PINK1磷酸化之后的泛素(pUb),在溶液中呈现两个慢交换的稳定构象—伸展态和收缩态[17-22].舒展态pUb与未磷酸化Ub具有高度相似的空间结构.与舒展态pUb相比,收缩态pUb碳端的β-片层向氮端收缩了两个氨基酸.更重要的是,除了构象数目和结构的变化以外,Ser65磷酸化还增强了泛素对溶液pH的敏感性,因此pUb的两种构象比例会随着溶液pH变化而变化[17, 19, 21].而我们进一步发现pUb两种构象的比例还受到温度的调控,该特性能够被用于温度传感器的开发.基于pUb对温度的敏感性,我们开发了一套19F化学标记pUb的温度传感器,利用19F NMR检测系统中pUb两种构象的比例,能够快速精确地测定生物样品的温度.该系统不仅能够用于检测生物样品的体外温度,还有望延伸用于检测细胞内的温度.
1 实验部分
1.1 实验材料
4-羟乙基哌嗪乙磺酸(HEPES)、三羟甲基氨基甲烷(Tris)、异丙基-β-D-硫代半乳糖苷(IPTG)、还原型谷胱甘肽(L-glutathione reduced)购自广州赛国生物科技有限公司;D-glucose、氯化钠(NaCl)、氯化镁(MgCl2)、磷酸二氢钾(KH2PO4)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、葡萄糖购自国药集团化学试剂有限公司;酵母粉(Yeast extract)、胰蛋白胨(Tryptone)购自Oxoid公司;二硫苏糖醇(DTT)购自北京博奥拓达科技有限公司;腺苷-5'-三磷酸二钠盐水合物(ATP·Na2·xH2O,配置为ATP母液)、二甲基亚砜(DMSO)购自生工生物工程(上海)股份有限公司;15N标记的氯化铵(15NH4Cl)购自Sigma-Aldrich;3-溴-1, 1, 1-三氟丙酮(BFA)购自北京百灵威科技有限公司.
1.2 质粒构建、蛋白表达和纯化
将人源Ub克隆到pET11a载体,然后采用QuikChange方法[23]分别引入D32C、K48C和Q62C突变(分别命名为D32C Ub、K48C Ub和Q62C Ub),大肠杆菌(BL21 star)细胞用于蛋白质表达,首先将质粒转化至大肠杆菌(BL21 star)感受态细胞中,并采用稀释涂布平板法涂布于细胞培养板上,37 ℃过夜培养后挑取单菌落接种于含氨苄青霉素的10 mL Luria-Bertani(LB)液体培养基中,在37 ℃、220 r/min摇床中培养,然后扩大到1 L含氨苄青霉素的LB液体培养基中继续培养,待吸光光度值OD600=0.6~0.9时,加入0.5 mmol/L IPTG于37 ℃诱导表达5 h.表达稳定同位素标记的野生型Ub蛋白(15N-Ub)时,使用15NH4Cl和D-glucose作为大肠杆菌生长的唯一氮源和碳源,并以M9培养基取代LB培养基.表达完成后收取菌液,使用Beckman离心机离心(5 000 rpm)10 min,收集沉淀.然后采用高压匀质仪高压破碎重悬的菌液(20 mmol/L醋酸钠,2 mmol/L DTT,pH 5.0),高速离心(20 000 rpm)20 min后取上清,先后采用SP-Sepharose Fast Flow阳离子交换树脂(GE Healthcare)和Sephacryl S100色谱柱(GE Healthcare)纯化即可得到纯化后的蛋白,液氮速冻后存于-80 ℃.
将磷酸化激酶PINK1克隆到pGEX-4T-1载体.大肠杆菌(BL21 star)细胞用于蛋白质表达,采用200 μmol/L IPTG在20 ℃下诱导表达16 h.PINK1蛋白的N端融合有GST(Glutathione S-transferase)标签,故采用Glutathione Sepharose 4B(GE Healthcare)初步纯化,然后再经过Sephacryl S100色谱柱(GE Healthcare)纯化即可.PINK1蛋白的整个纯化过程都在低温条件下进行,以保证酶的活性.
1.3 磷酸化蛋白的制备
将PINK1、15N-Ub(或D32C Ub、K48C Ub、Q62C Ub)、MgCl2和ATP以1:100:5 000:5 000的摩尔比在20 mmol/L Tris缓冲液(pH 8.0,含1 mmol/L DTT)中混合,于25 ℃水浴反应12 h.然后使用Source Q柱(GE Healthcare)纯化产物(磷酸化之后的蛋白质样品),并使用ESI-Q-TOF-MS(Agilent6530)测定精确分子量来确认.
1.4 19F化学标记蛋白制备
配置含有5 mol/L BFA的DMSO溶液.通过脱盐(Hi-Prep 26/10 Desalting柱,GE Healthcare)除去pUb半胱氨酸突变体缓冲液中(20 mmol/L醋酸钠,100 mmol/L NaCl,2 mmol/L DTT,pH 5.0)的DTT.然后在20 mmol/L HEPES缓冲液(pH 7.4)中以1:10的摩尔比混合泛素和探针,在室温25 ℃条件下反应2 h.然后使用脱盐(HiPrep 26/10脱盐柱,GE Healthcare)从反应混合物中纯化产物(19F标记的蛋白质),并利用电喷雾-四极杆-飞行时间质谱仪(ESI-Q-TOF-MS,Agilent6530)测定精确分子量来确认.
1.5 NMR实验和数据处理
将所有用于NMR实验的蛋白样品(15N-pUb、19F-D32C pUb、19F-K48C pUb和19F-Q62C pUb)溶于20 mmol/L HEPES缓冲液(pH 7.4,含150 mmol/L NaCl,5% D2O).
1H-15N HSQC实验在配备了低温探头的Bruker 600型NMR谱仪上进行.谱宽直接维F2为16 ppm,间接维F1为25 ppm,采样点数为t2×t1=2 048×256,1H-15N HSQC数据采用NMRPipe(version 2010.160.15.01)和CcpNmr(version 2.4.2)处理.
19F NMR实验均在配备了多通道低温探头的Bruker 600型NMR谱仪上进行,通过温度控制单元控制温度梯度.19F共振频率为564.39 MHz,谱宽为10 ppm,采样点数为8 k.pUb的19F NMR谱图中有两个峰,分别对应于两个构象状态——松弛状态和收缩状态.通过Bruker TopSpin 3.6.1对19F NMR的谱峰面积进行积分.
测定19F核的T1采用的脉冲序列为t1ir,采样次数为8,采样点数为64 k,谱宽为20 ppm;测定T2采用的脉冲序列为cpmg,采样次数为8,采样点数为64 k,谱宽为20 ppm,其中D20为0.000 16 s. 数据处理均在Bruker TopSpin 3.6.1上完成.
2 结果与讨论
2.1 pUb的两种构象比例随温度的变化
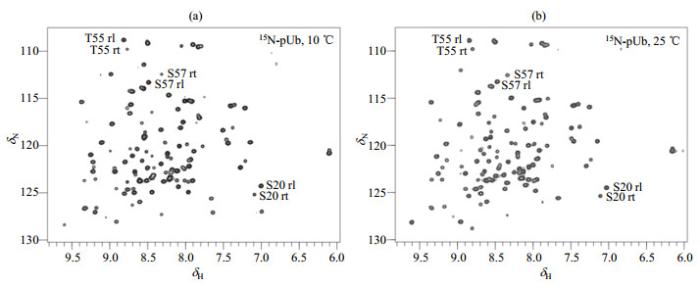
图1
图1
15N-pUb样品在(a) 10 ℃和(b) 25℃温度下的1H-15N HSQC谱图:当温度升高,舒展态(缩写为rl)的信号强度降低,收缩态(缩写为rt)的信号强度升高
Fig.1
1H-15N HSQC spectra of 15N-pUb sample at (a) 10 ℃ and (b) 25 ℃: When the temperature increases, the signal intensity of the relaxed state (rl) decreases, while the signal intensity of the retracted state (rt) increases
2.2 19F化学标记对泛素结构的影响
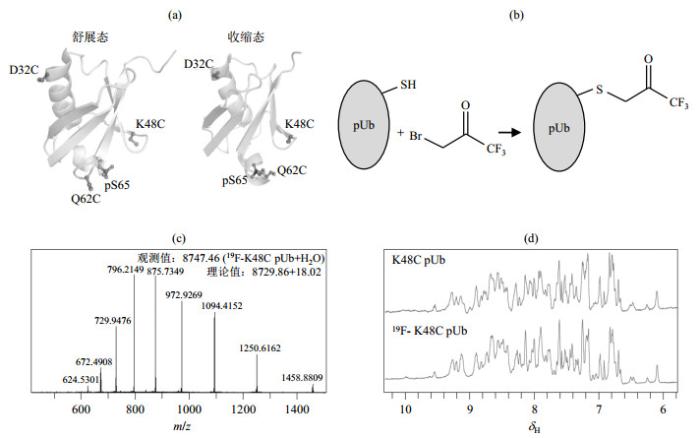
19F核的旋磁比与1H核相近,并且不存在于天然的生物大分子中,因此,利用19F NMR检测19F化学标记的蛋白质,能够采集到信噪比和分辨率均较高的19F NMR谱图,并用于分析目标分子的结构特征[24-27].为了完成19F的定点标记,我们选取pUb的D32、K48和Q62位点分别进行半胱氨酸突变,用于连接BFA探针[26][图 2(a)和2(b)].质谱结果显示pUb连接BFA探针后,19F-K48C pUb分子量为8 747.46 [图 2(c)],与理论分子量加上一个水分子(8 729.86+18.02)一致,表明19F探针成功连接于指定位点.通过比较BFA连接前后的pUb的1H NMR谱图,可以发现19F化学标记未影响pUb谱图的轮廓[图 2(d)],说明连接BFA探针的pUb保持了天然形态的二级结构和三级结构.由此可以推断,连接了BFA探针没有改变pUb的二级和三级结构,连接BFA探针后的pUb的伸展态和收缩态的构象比例仍然受到温度的调控.
图2
图2
(a) pUb舒展态和收缩态的示意图,用于连接BFA探针的半胱氨酸突变位点(D32C、K48C、Q62C)使用球棍模型显示,每次实验只突变其中一个;(b) BFA探针连接pUb突变体的示意图,BFA通过取代反应连接于pUb表面的半胱氨酸突变位点;(c)利用高分辨质谱测得的19F-K48C pUb的分子量为8 747.46,与理论分子量与一个水分子的分子量之和一致;(d) 19F化学标记K48C pUb前后的氨基氢的1H NMR谱,反应前后其轮廓未发生明显变化(25 ℃)
Fig.2
(a) pUbs in the relaxed state and retracted state are shown. The cysteine mutation sites (D32C, K48C, Q62C) for attachment of the BFA probe are displayed as ball and stick model, one mutation at each time; (b) Scheme of BFA reaction with pUb, BFA is connected to the cysteine mutation site on the surface of pUb through substitution reaction; (c) Mass spectrometry is used to confirm the reaction between BFA probe and K48C pUb, the result showed that the molecular weight of the protein after the reaction was 8 747.46, which was consistent with the sum of the theoretical molecular weight plus a water molecule; (d) The amino regions of 1H NMR spectra of K48C pUb before and after 19F chemical labeling, indicating no obvious change of the spectrum profile (25 ℃)
2.3 19F化学标记位点的优化
我们分别对连接了BFA探针的pUb突变体,包括19F-D32C pUb、19F-K48C pUb和19F-Q62C pUb进行了19F NMR实验.一维19F NMR谱图显示19F-D32C pUb的信号为重叠的双峰[图 3(a)],说明利用19F NMR能够捕获到pUb的两种构象,但是不同构象的信号高度重叠,这可能与19F标记位点距离磷酸化位点较远有关.重叠的NMR信号为快速准确地定量分析带来严重干扰.与19F-D32C pUb相比,19F-K48C pUb和19F-Q62C pUb的信号均为两个高分辨率的单峰[图 3(b)和3(c)].通过积分,获得19F-K48C pUb和19F-Q62C pUb中两种构象的比例(舒展态: 收缩态)分别约为50%: 50%和60%: 40%.19F-K48C pUb和19F-Q62C pUb之间构象比例的差别可能与标记位点有关:Q62C距离磷酸化位点较近,19F探针可能与磷酸根相互作用,进而影响了其NMR特征,最终造成峰强上的区别.已发表文献[19, 21, 22]指出在与本文相同溶液条件下pUb两种状态的比例约为5:5,因此19F-K48C pUb更能真实的反映出溶液中pUb构象的比例,因此在接下来的研究中我们以19F-K48C pUb为模型开发了温度传感器.本文还测定了19F-K48C pUb中舒展态T1为(327.73±1.35)ms,T2为(56.64±1.12)ms;收缩态T1为(331.61±2.18)ms,T2为(40.81±3.18)ms(图 4,实验温度为25 ℃).
图3
图3
(a) 19F-D32C pUb、(b) 19F-K48C pUb和(c) 19F-Q62C pUb在25 ℃条件下的19F NMR谱图
Fig.3
19F NMR spectra of (a) 19F-D32C pUb, (b) 19F-K48C pUb and (c) 19F-Q62C pUb at 25 ℃
图4
图4
(a) 19F-K48C pUb舒展态T1拟合;(b) 19F-K48C pUb收缩态T1拟合;(c) 19F-K48C pUb舒展态T2拟合;(d) 19F-K48C pUb收缩态T2拟合
Fig.4
(a) T1 fit for relaxed state of 19F-K48C pUb; (b) T1 fit for retracted state of 19F-K48C pUb; (c) T2 fit for relaxed state of 19F-K48C pUb; (d) T2 fit for retraced state of 19F-K48C pUb
2.4 19F-K48C pUb两种构象的比例随温度变化的19F NMR检测
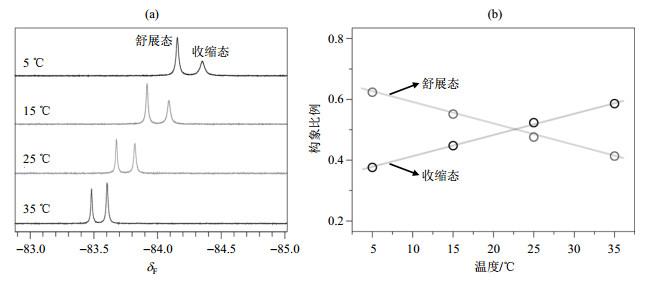
我们利用19F NMR实验检测了不同温度下19F-K48C pUb两种构象的比例.随着温度降低,低场区的信号强度逐渐升高[图 5(a)].该构象转换的现象与图 1中所观察到的现象一致,同时说明低场区的信号来自于舒展态,高场区的信号则来自于收缩态.通过对温度梯度下不同信号的面积进行积分[图 5(b)],得知收缩态的构象比例在5 ℃到35 ℃温度区间由~40%上升至~60%,而舒展态的构象比例则呈现出相应的下降趋势.在变温实验中,我们使用的pH 7.4的HEPES缓冲液.HEPES的pKa与温度的关系(ΔpKa/℃)为-0.014[28],因此当温度从5 ℃升高至35 ℃时,HEPES缓冲液的pH将从~7.7降至~7.3.已发表的文献指出降低pH能够增加舒展态比例,而升高pH则能够增加收缩态比例[21].但是本文结果显示:温度升高(pH降低)时,收缩态的比例上升;而温度降低(pH升高)时,舒展态比例上升.这种趋势与上述文献报道的相反,说明本研究中温度梯度中,19F-K48C pUb两种构象的比例变化反映的是温度的影响.
图5
图5
(a) 不同温度下19F-K48C pUb的19F NMR谱图;(b)两种构象的比例变化和温度梯度之间呈线性
Fig.5
(a) The 19F NMR spectra of 19F-K48C pUb at different temperature; (b) The linear relationship between the ratio change of the two conformations and the temperature gradient
通过对温度和构象比例进行拟合,我们发现pUb构象比例变化与温度梯度之间为线性关系,测定pUb构象比例之后可以根据相关方程(收缩态:y=0.007x+0.342 6;舒展态y=-0.007x+0.657 4.y为构象比例,x为温度)计算对应的温度.从热力学平衡的角度来看,从舒展态转化到收缩态应该是一个吸热的一元反应,因此平衡常数随着温度的变化而变化.
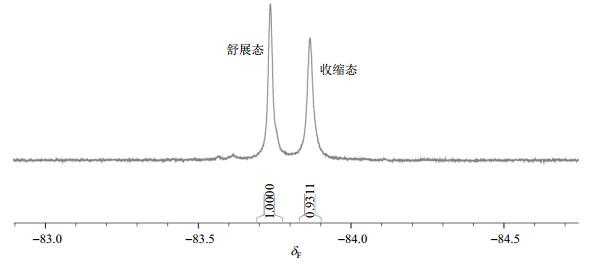
我们进一步对该方程进行了验证,测定了293.15 K下19F-K48C pUb的19F NMR谱图(图 6),由图中积分面积可计算出,此时收缩态比例为0.482 1,舒展态比例为0.517 8,分别代入舒展态和收缩态线性方程,计算得出此时温度为19.93 ℃(293.08 K),与理论值的误差为0.07 ℃,说明该温度传感器在其可观测范围内准确性较高.
图6
图6
293.15 K下19F-K48C pUb的19F NMR谱
Fig.6
19F NMR spectrum of 19F-K48C pUb at 293.15 K
细胞内NMR作为目前为数不多的蛋白质原位检测手段,能够检测反应生物分子在天然环境中的结构特征,而蛋白质结构特征与其所处环境温度息息相关.目前已发表的利用NMR检测的温度传感器主要依托于RNA二级结构对特定温度的敏感性,但只能提供有限的温度量程.而pUb具有较好的耐热性,它的空间结构的熔点约为70 ℃[22],因此能够用于检测较大范围的温度变化.而且采用19F NMR检测19F-pUb构象比例的变化,并利用构象比例的变化与温度之间的关系(温度每升高1 ℃,舒展态或者收缩态的比例将会下降或者升高~0.7%)可以直接反馈样品温度的变化,因此可作为一种基于NMR检测的温度传感器.并且这种温度传感器不仅仅可以用于体外实验,还有望延伸至细胞内的温敏检测,例如将19F-pUb转移至细胞内部,利用原位NMR检测技术,实时监测细胞内部温度,助力揭示蛋白质结构与功能的关系.
3 结论
本研究首先发现pUb的两种构象比例受到温度影响而变化.基于该特征,本文开发了一套基于NMR检测的温度传感器.我们对pUb进行了19F化学标记,并利用19F NMR技术表征了不同温度下pUb两种构象的比例,建立了构象比例变化与温度之间的关系,利用这一关系能够很好的检测温度的变化.这温度传感器不仅可适用于基于NMR的体外温度检测,而且有望用于细胞内温度检测.
无
参考文献
Thermogenesis in muscle
[J].DOI:10.1146/annurev.ph.56.030194.002535 [本文引用: 1]
Why molecules move along a temperature gradient
[J].DOI:10.1073/pnas.0603873103 [本文引用: 1]
Quantum dot nano thermometers reveal heterogeneous local thermogenesis in living cells
[J].DOI:10.1021/nn201142f [本文引用: 1]
Thermogenic mechanisms in brown fat
[J].DOI:10.1152/physrev.1984.64.1.1
Thermogenic mechanisms and their hormonal regulation
[J].DOI:10.1152/physrev.00009.2005 [本文引用: 1]
Sarcolipin is a newly identified regulator of muscle-based thermogenesis in mammals
[J].
Fever and hypothermia in systemic inflammation
[J].
Neural mechanisms of inflammation-induced fever
[J].DOI:10.1177/1073858418760481 [本文引用: 1]
Mitochondria are physiologically maintained at close to 50℃
[J].DOI:10.1371/journal.pbio.2003992 [本文引用: 1]
Mitochondrial uncoupling proteins in the CNS: in support of function and survival
[J].DOI:10.1038/nrn1767
Mitochondria-targeted fluorescent thermometer monitors intracellular temperature gradient
[J].DOI:10.1039/C5CC01088H [本文引用: 1]
Intracellular thermometry with fluorescent sensors for thermal biology
[J].DOI:10.1007/s00424-018-2113-4 [本文引用: 1]
Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response
[J].DOI:10.1371/journal.pone.0172344 [本文引用: 1]
Molecular basis for temperature sensing by an RNA thermometer
[J].DOI:10.1038/sj.emboj.7601128 [本文引用: 1]
Structure of ubiquitin refined at 1.8Å
[J].DOI:10.1016/0022-2836(87)90679-6 [本文引用: 1]
The ubiquitin code
[J].DOI:10.1146/annurev-biochem-060310-170328 [本文引用: 1]
How phosphorylation by PINK1 remodels the ubiquitin system: a perspective from structure and dynamics
[J].DOI:10.1021/acs.biochem.9b00715 [本文引用: 2]
PINK1 phosphorylates ubiquitin to activate Parkin E3 ubiquitin ligase activity
[J].
Ubiquitin is double-phosphorylated by PINK1 for enhanced pH-sensitivity of conformational switch
[J].DOI:10.1007/s13238-019-0644-x [本文引用: 2]
Ubiquitin is phosphorylated by PINK1 to activate parkin
[J].
Ubiquitin S65 phosphorylation engenders a pH-sensitive conformational switch
[J].
Ubiquitin Ser65 phosphorylation affects ubiquitin structure, chain assembly and hydrolysis
[J].DOI:10.15252/embj.201489847 [本文引用: 4]
QuikChange shuffling: a convenient and robust method for site-directed mutagenesis and random recombination of homologous genes
[J].DOI:10.1016/j.nbt.2011.03.001 [本文引用: 1]
19F NMR: a valuable tool for studying biological events
[J].DOI:10.1039/c3cs60129c [本文引用: 1]
Current applications of 19F NMR to studies of protein structure and dynamics
[J].DOI:10.1016/j.pnmrs.2011.06.003
Simultaneous detection of distinct ubiquitin chain topologies by 19F NMR
[J].DOI:10.1021/cb500589c [本文引用: 1]
Use of 19F NMR to probe protein structure and conformational changes
[J].DOI:10.1146/annurev.bb.25.060196.001115 [本文引用: 1]
Hydrogen ion buffers for biological research
[J].DOI:10.1021/bi00866a011 [本文引用: 1]