引言
13C核磁共振(13C NMR)具有分辨率高、化学位移分布宽、信号重叠小的优点,在石化产品、聚合物、天然产物、药物的分析表征中得到广泛应用[1⇓-3].通常采用单脉冲激发结合反门控1H去耦获得13C NMR谱.但由于13C核的天然丰度只有1.1%,导致其检测灵敏度低,需要足够多的采样次数才能获得一张信噪比较好的13C NMR谱.另外,13C核的纵向弛豫时间(T1)较长,采用上述的常规方法进行定量的13C NMR检测需要花费很长的实验时间,效率较低,限制了13C NMR在定量检测方面的应用.为增强13C NMR信号强度,减少测试时间,DEPT(Distortionless Enhancement by Polarization Transfer,无畸变的极化转移增强)[4,5]和重聚INEPT(Refocused Insensitive Nuclei Enhanced by Polarization Transfer,不灵敏核的重聚极化转移增强)[6,7]等基于J耦合的极化转移技术被引入到13C NMR检测中.DEPT和重聚INEPT都是将极化从高旋磁比的1H核传递给低旋磁比的13C核,以提高13C核的极化度,从而增强其NMR信号.在常规的DEPT和重聚INEPT实验中,处于不同基团的13C核获得的极化增强是不均一的.即使是同一类型的基团,由于碳氢J耦合常数(JCH)不一样,13C核获得的极化增强也不一致.这使得常规的DEPT和重聚INEPT技术只适用于定性的13C NMR检测,不能推广到定量检测中.
为解决这个问题,研究人员提出在DEPT、重聚INEPT脉冲序列中循环特定的延迟、脉宽参数集.通过信号叠加,消除J耦合调制的影响,得到均一的13C信号增强,使得定量测量成为可能.该想法最初应用于获取定量1H-13C异核单量子相关谱[8].通过在脉冲序列中循环一组特定的延迟,可以在较宽的JCH范围(115~220 Hz)内,实现信号的均一增强.Henderson[9]将这一思路引入到DEPT实验中,提出了定量DEPT(Q-DEPT)方法.该方法通过循环读脉冲的翻转角度和极化转移时间,使不同自旋体系在一定的JCH范围内,获得近似相等的极化转移效率.但在积算符理论推导中,Q-DEPT方法近似认为极化转移效率只与sin2(πΔ1JCH)项有关,忽略了其他项的贡献,造成CH2和CH3基团的定量偏差较大.针对Q-DEPT中存在的问题,Jiang等人[10]在严密的理论分析基础上提出了Q-DEPT+方法,序列中采用6个读取脉冲翻转角和8个极化转移时间的组合,使CH、CH2和CH3定量结果的标准偏差小于5%,并将JCH范围扩大到90~230 Hz. 近来该团队又利用遗传算法进一步优化了Q-DEPT+方法的极化转移时间和读取脉冲的宽度,并用对频偏效应有补偿作用的G5组合脉冲取代了13C通道的180˚硬脉冲.实验结果显示优化的序列在定量准确性和灵敏度两方面均有明显提高[11].积算符理论分析指出,DEPT的可观测算符中存在反向单量子相干,造成的相位畸变在强耦合体系中表现明显.DEPT++方法[12]可以有效地消除这些反向单量子相干,解决谱畸变的问题.因此为了保障定量的准确性,Li等人[13]以DEPT++为基础,结合Q-DEPT+中使用的翻转角度和极化转移时间组合,建立了Q-DEPT++方法,可以有效消除相位畸变的问题.在食用油脂肪酸成分的测量中,采用了J选择定量DEPT(J-Selective Quantitative DEPT)[14].该方法根据脂肪酸中JCH的分布,进行针对性优化,进一步增强了13C信号.
重聚INEPT实验中仅需调制极化转移和重聚时间,对实验条件变化不敏感,可控性更高,因此Mäkelä等人[15]提出了基于重聚INEPT的定量方法,命名为Q-INEPT-CT(Quantitative refocused constant-time INEPT).首先采用拟牛顿非线性回归算法,针对115~170 Hz范围内的JCH,优化序列中的极化转移和重聚时间参数.以极化转移效率的最大值与最小值的差值最小化为目标,优化得到8对极化转移时间和重聚时间组合.在实验中,通过循环这8对时间参数,使不同的自旋体系产生均一的信号增强.另外,为保持每次演化中弛豫对信号强度具有相同的影响程度,采用了“恒时”方法,使得Q-INEPT-CT序列总演化时间固定.Manu等人[16]采用遗传算法,在不同的约束条件下优化得到多组延迟参数集,改善了Q-INEPT-CT序列.但该方法中采用的梯度场及“恒时”技术,使序列变得复杂,增加了实验调试的难度,不利于推广.2017年,Hou等人[17]提出了不灵敏核的定量绝热重聚极化转移增强方法(Quantitative Adiabatic Refocused Insensitive Nuclei Enhanced by Polarization Transfer,QA-RINEPT).此方法采用不灵敏核绝热重聚极化转移增强序列,利用不同基团在重聚INEPT演化曲线上的相交点,结合校正因子实现快速准确的定量13C NMR检测.序列在13C通道采用了反转和重聚绝热脉冲,克服射频场不均匀性和频率偏置效应的影响.该方法被应用于乙烯-辛烯共聚物以及聚多元醇的定量13C NMR表征中[18].Tu等人[19]简化了QA-RINEPT方法中寻找定量点的实验步骤,并将其用于测定工业级三元乙丙橡胶的成分含量.QA-RINEPT方法主要存在两个问题,一是其理论基础决定了该方法只适合JCH简单的体系,当样品的JCH分布较宽,则很难寻找到合适的定量点;二是该方法需要采用与实际样品近似的模型化合物进行预实验,以确定定量点,不是很便捷,不利于大范围的使用.
为克服上述问题,进一步拓展重聚INEPT在定量检测中的应用,本文提出了基于模拟退火优化的定量重聚INEPT(Quantitative Refocused INEPT,Q-RINEPT)方法.该方法以重聚INEPT序列为基础,采用模拟退火算法(Simulated Annealing)进行优化,构建极化转移和重聚时间参数集,实现不同基团中13C核的均一极化转移增强.在序列中采用180˚组合脉冲,减小射频场不均匀性和频率偏置效应的影响,消除了相位扭曲,提高了检测的可靠性.采用模型化合物进行了验证,并将该方法应用到大豆油脂肪酸含量的定量检测中.
1 实验部分
1.1 试剂与仪器
青蒿素(Artemisinin,C15H22O5,98%)、辛伐他丁(Simvastatin,C25H38O5,≥ 97%),购于上海阿拉丁生化科技股份有限公司;3个品牌的大豆油,购于本地超市;氘代氯仿(CDCl3,99.9%氘代),购于美国Cambridge Isotope Laboratories公司.
所用仪器主要有:AVANCE HD III 500 MHz液体NMR谱仪(配有5 mm宽带双共振Prodigy低温探头),瑞士布鲁克公司;AL104电子天平,梅特勒-托利多仪器(上海)有限公司;移液器,德国艾本德公司;5 mm NMR样品管,美国诺雷尔公司.
1.2 样品制备
用天平称取62.7 mg青蒿素于离心管中,加入0.6 mL氘代氯仿,待其完全溶解后,转移到5 mm NMR样品管中.用天平称取53.6 mg辛伐他丁于离心管中,加入0.6 mL氘代氯仿,待其完全溶解后,转移到5 mm NMR样品管中;用移液器吸取0.2 mL大豆油于离心管中,加入0.4 mL氘代氯仿,待其完全混合后,转移到5 mm NMR样品管中.
1.3 NMR实验
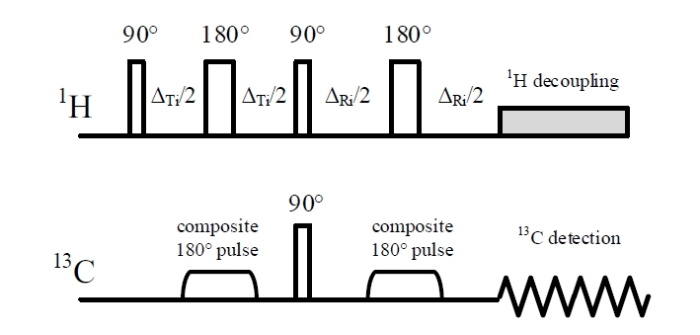
测试均在500 MHz液体核磁共振谱仪上完成,使用5 mm宽带双共振Prodigy低温探头,实验温度298 K. Q-RINEPT序列(图1)是在Burum等人[7]提出的原始重聚INEPT序列基础上,引入优化的极化转移和重聚时间参数集构建而成.同时,为了减小射频场不均匀性和频率偏置效应的影响,在新序列中采用180˚组合脉冲代替原序列中13C通道的180˚硬脉冲.Q-RINEPT实验中,1H通道的90˚脉冲和180˚脉冲分别设置为11.4 μs和22.8 μs,13C通道的90˚脉冲设置为10.8 μs.180˚组合脉冲由相位交替变化、翻转角不同的6个硬脉冲组成(158.0˚x171.2˚-x342.8˚x145.5˚-x81.2˚x85.3˚-x)[20].弛豫延迟时间(d1)设为6.0 s.常规的定量13C谱采用“45˚单脉冲+反门控去耦”序列(zgig45)采集[21].为保证13C信号完全弛豫,zgig45实验中的d1要设置为>5T1(13C),通常不小于30 s.两种实验中均采用waltz16组合脉冲去耦,90˚去耦脉宽为100 μs. 谱宽设为160.3 ppm,采样点数32 768,FID采集时间0.81 s,空扫4次.13C NMR谱化学位移以溶剂(CDCl3)的共振峰定标.
图1
图1
Q-RINEPT脉冲序列
Fig. 1
The pulse sequence of quantitative refocused INEPT (Q-RINEPT)
2 结果与讨论
2.1 极化时间参数集的优化
2.1.1 用于Q-RINEPT的优化参数集
对于常规重聚INEPT实验,采用积算符理论,可以得到甲基(CH3)、亚甲基(CH2)和次甲基(CH)中1H-13C的极化转移效率公式[7],如下:
其中,JCH表示单键碳氢J耦合常数,ΔT和ΔR分别代表序列中的极化转移时间和极化重聚时间.可见,13C核的极化增强依赖于基团类型、碳氢J耦合常数、极化转移时间和极化重聚时间.可以通过改变序列中极化转移时间和极化重聚时间的长度,调制13C核的信号强度和相位.但通过单一的一组极化转移时间和极化重聚时间使不同类型13C核获得一致的极化增强是困难的.因此需要引入多组极化转移和极化重聚时间参数,相应的1H-13C极化转移效率为:
其中,ΔTi和ΔRi表示第i组极化转移和极化重聚时间参数,m表示参数集中极化转移和极化重聚时间的总组数.Q-RINEPT方法是在一定的JCH范围内,选择合适的m组极化转移和极化重聚时间参数,通过一系列的信号叠加,消除J耦合调制的影响,实现不同13C核最大程度的均一极化转移,即PCH ≈ PCH2 ≈ PCH3.
有机化合物中,甲基、亚甲基和次甲基的JCH范围存在一定差异[22].甲基的JCH范围较小,通常在125 Hz左右.而次甲基的键连情况比较复杂,其JCH范围较宽.本文中,根据三种基团JCH的实际分布,将甲基、亚甲基和次甲基的JCH范围分别设置为120~135、120~180和120~220 Hz.
在上述给定的JCH范围内,通过模拟退火算法寻找最优极化转移和极化重聚时间参数集,使不同基团最大程度上获得均一的极化转移.模拟退火是一种常用的优化算法,源于材料高温退火机理,采用蒙特卡洛迭代求解策略进行随机寻优,能有效避免陷入局部极值并最终趋于全局最优,在控制工程、信号处理和神经网络等领域中已得到广泛应用[23].本文中,参数集包含8组极化转移和极化重聚时间参数([(ΔTi,ΔRi)]i=1,2,⋯,8).以1H-13C极化转移效率最大值与最小值的差值平方和构建为模拟退火优化中的目标函数:
(7)式中,Pmax和Pmin分别表示在给定的JCH范围内依据公式(4)~(6)计算得到的极化转移效率最大值和最小值.采用MATLAB编写优化程序,搜寻使目标函数值最小的极化转移和重聚时间参数集.优化得到的极化转移和重聚时间参数集(称为Case I)如下:
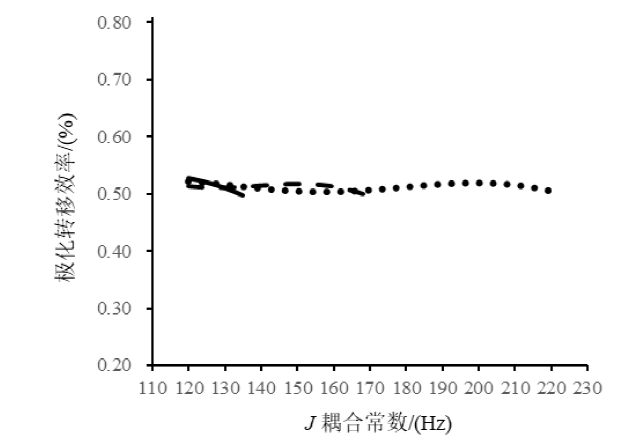
图2
图2
对于Q-RINEPT,3种基团的极化转移效率曲线(CH3, 120~135 Hz, ━; CH2, 120~180 Hz, ; CH, 120~220 Hz, •••)
Fig. 2
Polarization transfer efficiency curves of methyl, methylene and methine groups for Q-RINEPT (CH3, 120~135 Hz, ━; CH2, 120~180 Hz, ; CH, 120~220 Hz, •••)
2.1.2 用于定量谱编辑的优化参数集
重聚INEPT可用于区分有机化合物CH3、CH2和CH的13C共振峰[5,7].将脉冲序列中极化转移时间固定为0.5/JCH,当极化重聚时间设为0.5/JCH,理论上观察到的只是CH信号.当极化重聚时间设为0.75/JCH,获得的13C谱中CH、CH3共振峰应为正,CH2共振峰应为负.因此通过两次重聚INEPT实验可以定性区分13C谱中不同基团的信号.需要注意的是,有机化合物中JCH并不都是一个值,而是有一定分布.虽然通常按照JCH的中间值设定极化转移和重聚时间,但这样必然与测试分子实际的JCH存在一定偏差,会导致谱线强度偏离,干扰不同基团信号的区分,不利于复杂、密集共振峰的判断分析.因此,我们进一步采用模拟退火算法,通过优化的极化转移和重聚时间参数集,使CH、CH2和CH3基团各自获得最大可能的均一极化转移,即同一种基团内极化转移效率近似一致,不同基团之间极化转移效率的比值相对固定.在一张13C NMR谱中,既可以通过共振峰的积分区分CH、CH2和CH3基团,又可以对同一类型的基团进行定量比较.该方法可以称之为定量谱编辑.
优化得到的极化转移和重聚时间参数集(Case II)如下:
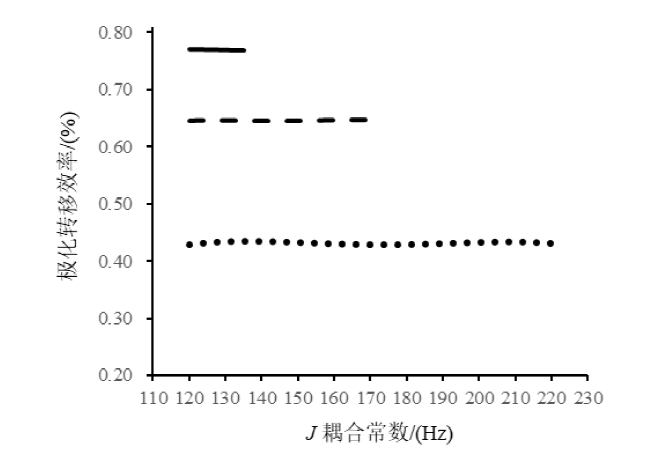
将Case II极化时间参数集代入公式(4)~(6)中,计算在不同JCH情况下3种基团极化转移效率的变化曲线(如图3所示).3条曲线都比较平坦,CH、CH2和CH3的平均极化转移效率分别为43.2%±0.2%、64.7%±0.1%和77.0%±0.1%,同一种基团内极化转移效率基本一致.CH2和CH3的极化转移效率分别是CH的1.50和1.78倍.因此在定量谱编辑实验中,CH共振峰的积分最小,CH3共振峰的积分最大,CH2共振峰的积分居中,并且CH2、CH3共振峰与CH共振峰的积分比值分别在1.50和1.78左右.
图3
图3
对于定量谱编辑,3种基团的极化转移效率曲线(CH3, 120~135 Hz, ━; CH2, 120~180 Hz, ; CH, 120~220 Hz, •••)
Fig. 3
Polarization transfer efficiency curves of methyl, methylene and methine groups for quantitative spectral editing (CH3, 120~135 Hz, ━; CH2, 120~180 Hz, ; CH, 120~220 Hz, •••)
2.2 定量检测
2.2.1 青蒿素测试结果
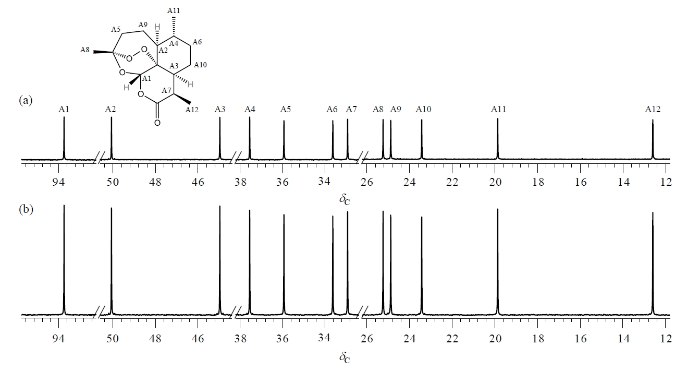
青蒿素是治疗疟疾的特效药,化学式为C15H22O5,含有3个伯碳(CH3),4个仲碳(CH2),5个叔碳(CH)和3个季碳,JCH分布范围较大,其结构如图4中所示(骨架上的碳原子按化学位移从大到小编号,季碳未标注)[24].Q-RINEPT实验中,采用Case I极化时间参数集,累加64次,总测试时间为7.3 min.为了对比,常规定量13C NMR谱采用zgig45序列采集,d1设为30 s,累加64次,总测试时间为32.9 min.两种实验各重复3次.对采集到的13C NMR谱(图4)进行积分,相关结果列于表1中.忽略同位素的影响,同一分子中各种13C核的数目是相同的,也就是在测试样品中其摩尔数相等.因此定量13C NMR谱中,各共振峰的积分面积应基本相等,标准偏差越小说明定量越准确.在Q-RINEPT 13C谱中,各共振峰的积分面积基本相当,平均值为1.003,标准偏差为0.016.而常规定量13C谱中,积分平均值为0.405,标准偏差为0.005.采用Q-RINEPT方法,青蒿素各共振峰平均增加1.48倍,实现了不同基团中13C核的均一极化增强.两种方法测试结果的相对标准偏差分别为1.6%和1.2%,说明Q-RINEPT在精密度方面接近常规定量13C NMR测试.在Q-RINEPT实验中,d1的设置参考1H纵向弛豫时间.而1H的纵向弛豫时间远小于13C的纵向弛豫时间.因此相对于常规的定量13C NMR测试,Q-RINEPT实验耗时更少.在青蒿素的测试中,Q-RINEPT所用的时间比常规定量13C NMR测试减少了77.8%.上述实验结果表明,Q-RINEPT方法有效可靠,满足快速定量检测的要求.与Mäkelä等人[15]提出的Q-INEPT-CT方法相比,Q-RINEPT没有采用梯度和“恒时”演化方案,更易于调试和操作.对于CH基团,Q-RINEPT适用的JCH范围更广,为120~220 Hz,而Q-INEPT-CT则限制于115~170 Hz.
图4
图4
青蒿素样品的定量13C NMR谱.(a) zgig45脉冲序列采集;(b) Q-RINEPT脉冲序列采集
Fig. 4
Quantitative 13C NMR spectra of artemisinin sample obtained by (a) zgig45 and (b) Q-RINEPT
表1 青蒿素13C NMR谱的定量积分结果
Table 1
| 编号 | 化学位移 | 基团 | 积分面积 | 倍数 | |
|---|---|---|---|---|---|
| zgig45 | Q-RINEPT | ||||
| A1 | 93.74 | CH | 0.402±0.001 | 1.009±0.004 | 2.51 |
| A2 | 50.08 | CH | 0.400±0.006 | 0.985±0.002 | 2.47 |
| A3 | 44.97 | CH | 0.404±0.001 | 1.002±0.001 | 2.48 |
| A4 | 37.54 | CH | 0.409±0.002 | 0.987±0.001 | 2.41 |
| A5 | 35.92 | CH2 | 0.402±0.007 | 0.994±0.006 | 2.47 |
| A6 | 33.61 | CH2 | 0.404±0.005 | 0.985±0.002 | 2.44 |
| A7 | 32.92 | CH | 0.404±0.006 | 0.999±0.007 | 2.47 |
| A8 | 25.23 | CH3 | 0.401±0.005 | 1.017±0.002 | 2.54 |
| A9 | 24.86 | CH2 | 0.402±0.002 | 1.001±0.005 | 2.49 |
| A10 | 23.42 | CH2 | 0.417±0.005 | 1.002±0.002 | 2.40 |
| A11 | 19.86 | CH3 | 0.411±0.009 | 1.047±0.004 | 2.55 |
| A12 | 12.60 | CH3 | 0.407±0.003 | 1.005±0.007 | 2.47 |
| 平均值±标准偏差 | 0.405±0.005 | 1.003±0.016 | 2.48 | ||
| 相对标准差 | 1.2% | 1.6% | |||
2.2.2 辛伐他丁测试结果
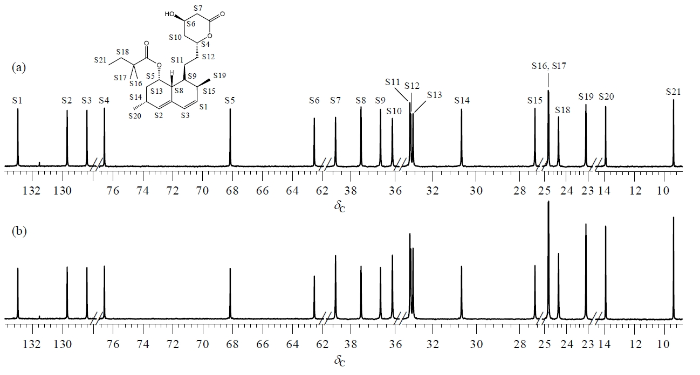
辛伐他丁是一种降血脂药物,化学式为C25H38O5,含有5个伯碳(CH3),6个仲碳(CH2),10个叔碳(CH)和4个季碳,其结构如图5中所示(骨架上的碳原子按化学位移从大到小编号,季碳未标注)[25].分别采用Case I和Case II极化时间参数集,进行Q-RINEPT实验和定量谱编辑实验.d1设为6.0 s,累加64次.对采集到的13C NMR谱(图5)进行积分,相关结果列于表2中.对于辛伐他丁,Q-RINEPT基本实现了不同基团中13C核的极化均一增强,各共振峰的积分面积基本相当,叔碳、仲碳、伯碳共振峰的积分平均值分别为0.976、0.970和1.011,对应的相对标准偏差分别3.4%、3.3%和0.8%.根据表2的数据,可知在定量谱编辑实验中,辛伐他丁骨架上同类型基团的共振峰基本一致,叔碳、仲碳、伯碳共振峰的积分平均值分别为0.875、1.271和1.551,对应的相对标准偏差分别3.0%,2.8%和1.0%,仲碳、伯碳共振峰与叔碳共振峰的积分比值分别为1.43和1.75.从谱图[图5(b)]上也可以观察到,叔碳共振峰的强度较小,伯碳共振峰的强度最高,仲碳共振峰居中.因此以重聚INEPT序列为基础,采用Case II极化时间参数集,可以实现定量谱编辑,即通过极化转移、极化重聚时间参数集的调制,将不同类型基团的共振峰在强度加以区别,同时又保持同类型基团共振峰强度基本一致,可以定量比较.
图5
图5
辛伐他丁样品的13C NMR谱.(a) Q-RINEPT实验(采用Case I参数集);(b)定量谱编辑实验(采用Case II参数集)
Fig. 5
13C NMR spectra of simvastatin sample obtained by (a) Q-RINEPT with Case I set and (b) quantitative spectral editing with Case II set
表2 辛伐他丁13C NMR谱的定量积分结果
Table 2
| 编号 | 化学位移 | 基团 | 积分面积 | |||
|---|---|---|---|---|---|---|
| A | 平均值±标准偏差 | B | 平均值±标准偏差 | |||
| S1 | 132.95 | CH | 1.002 | 0.976±0.033 | 0.871 | 0.875±0.027 |
| S2 | 129.72 | CH | 0.993 | 0.913 | ||
| S3 | 128.42 | CH | 0.990 | 0.896 | ||
| S4 | 76.58 | CH | 0.970 | 0.877 | ||
| S5 | 68.17 | CH | 1.035 | 0.887 | ||
| S6 | 62.54 | CH | 0.910 | 0.804 | ||
| S8 | 37.53 | CH | 0.995 | 0.872 | ||
| S9 | 36.65 | CH | 0.945 | 0.873 | ||
| S14 | 30.68 | CH | 0.957 | 0.874 | ||
| S15 | 27.30 | CH | 0.965 | 0.884 | ||
| S7 | 38.68 | CH2 | 0.936 | 0.970± 0.032 | 1.202 | 1.271±0.036 |
| S10 | 36.12 | CH2 | 0.935 | 1.262 | ||
| S11 | 33.05 | CH2 | 0.982 | 1.291 | ||
| S12 | 33.01 | CH2 | 0.982 | 1.291 | ||
| S13 | 32.90 | CH2 | 1.027 | 1.317 | ||
| S18 | 24.36 | CH2 | 0.959 | 1.263 | ||
| S16 | 24.83 | CH3 | 1.008 | 1.011±0.008 | 1.536 | 1.551±0.015 |
| S17 | 24.81 | CH3 | 1.008 | 1.536 | ||
| S19 | 23.10 | CH3 | 1.026 | 1.574 | ||
| S20 | 13.93 | CH3 | 1.012 | 1.545 | ||
| S21 | 9.39 | CH3 | 1.001 | 1.565 | ||
A:Q-RINEPT,采用Case I参数集;B:定量谱编辑,采用Case II参数集
2.2.3 大豆油中脂肪酸含量的测定结果
食用植物油的主要成分是三脂肪酸甘油酯(简称甘油三酯).从分子结构来看,甘油三酯包括甘油基和脂肪酰基,是由一个甘油分子与三个长直链脂肪酸分子酯化结合而成,其中脂肪酸长链占甘油三酯分子质量的95%左右[26].甘油三酯的脂肪酸组成对油脂的性质有重要影响.目前,检测植物油中脂肪酸含量主要采用气相色谱法[27].该方法需对样品进行甲酯化预处理,操作较繁琐.核磁共振技术已应用到植物油中亚麻酸、亚油酸、油酸等不饱和脂肪酸以及总饱和脂肪酸含量的定量分析,具有样品无需预处理、操作相对简便的特点[28⇓⇓⇓-32].本文中采用Q-RINEPT方法测量了大豆油中的脂肪酸含量,并和常规的定量13C NMR的测试结果进行对比.
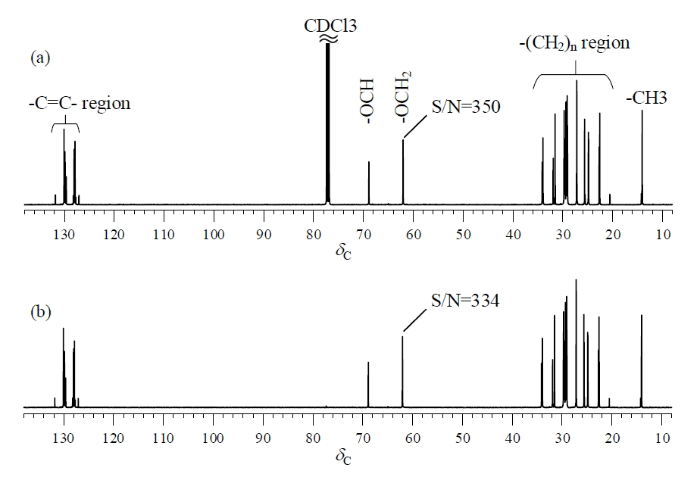
图6显示了分别采用Q-RINEPT和zgig45序列采集的大豆油定量13C谱.谱图中的共振峰大致分为3个区域:化学位移小于δC 35的信号来自脂肪酸碳链上多个位置的亚甲基以及端甲基;δC 60~70之间的共振峰来自甘油骨架上的亚甲基(-OCH2)和次甲基(-OCH);不饱和脂肪酸碳链上烯碳信号出现在δC 127~132之间.由图6可知,对于采集定量13C谱,Q-RINEPT方法的效率远高于zgig45序列.采用zgig45序列累加256次,甘油骨架上亚甲基共振峰(δC 62.1)的信噪比(S/N)为350,实验时间总计152.7 min.而采用Q-RINEPT则只需32次累加,即可获得近似的信噪比(334),实验时间为3.6 min.耗时大约是常规13C NMR定量测试的2.4%,效率提高了41.4倍.
图6
图6
大豆油样品的定量13C NMR谱.(a) zgig45序列采集,d1为35 s,累加次数256.大豆油中季碳信号未显示;(b) Q-RINEPT序列采集,d1为6 s,累加次数32
Fig. 6
Quantitative 13C NMR spectra of soybean oil sample obtained by (a) zgig45 with scans of 256 and relaxation delay of 35 s; (b) Q-RINEPT with scans of 32 and relaxation delay of 6 s
图7
图7
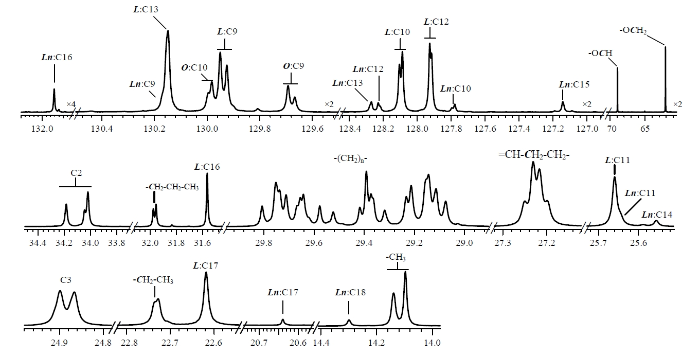
分段显示并标注大豆油Q-RINEPT 13C谱中的特征峰.Ln表示亚麻酸碳链,L表示亚油酸碳链,O表示油酸碳链
Fig. 7
Labeled resonances in the Q-RINEPT 13C spectrum of soybean oil sample. Ln, linolenic acid chain; L, linoleic acid chain; O, oleic acid chain
表3 大豆油Q-RINEPT 13C谱中特征峰的化学位移和归属
Table 3
| 序号 | 化学位移 | 归属 | 序号 | 化学位移 | 归属 | |
|---|---|---|---|---|---|---|
| 1 | 131.89 | Ln:C16(=CH) | 15 | 34.19, 34.05, 34.02 | C2 (-OC-CH2-) | |
| 2 | 130.17 | Ln:C9(=CH) | 16 | 31.98, 31.96 | -CH2-CH2-CH3 | |
| 3 | 130.15 | L:C13(=CH) | 17 | 31.57 | L:C16(-CH2-CH2-CH3) | |
| 4 | 130.00, 129.98 | O:C10(=CH) | 18 | 29.87~28.99 | -(CH2)- | |
| 5 | 129.95, 129.93 | L:C9(=CH) | 19 | 27.30~27.15 | =CH-CH2-CH2- | |
| 6 | 129.69, 129.67 | O:C9(=CH) | 20 | 25.66 | L:C11 (=CH-CH2-HC=) | |
| 7 | 128.27 | Ln:C13(=CH) | 21 | 25.64 | Ln:C11 (=CH-CH2-HC=) | |
| 8 | 128.23, 128.22 | Ln:C12(=CH) | 22 | 25.56 | Ln:C14 (=CH-CH2-HC=) | |
| 9 | 128.10, 128.09 | L:C10(=CH) | 23 | 24.90, 24.87 | C3(-OC-CH2-CH2-) | |
| 10 | 127.93, 127.91 | L:C12(=CH) | 24 | 22.73 | -CH2-CH3 | |
| 11 | 127.79, 127.78 | Ln:C10(=CH) | 25 | 22.62 | L:C17 (-CH2-CH3) | |
| 12 | 127.14 | Ln:C15(=CH) | 26 | 20.58 | Ln:C17 (-CH2-CH3) | |
| 13 | 68.94 | 甘油基, -OCH | 27 | 14.30 | Ln:C18 (-CH3) | |
| 14 | 62.10 | 甘油基, -OCH2 | 28 | 14.14, 14.10 | -CH3 |
其中,O%表示油酸含量,L%表示亚油酸含量,Ln%表示亚麻酸含量,S%表示饱和脂肪酸含量.IO:C9表示油酸碳链上C9共振峰的面积,IL:C10表示亚油酸碳链上C10共振峰的面积,ILn:C15表示亚麻酸碳链上C15共振峰的面积.IC3表示各脂肪酸碳链上C3共振峰的积分面积.计算结果见表4.
表4 采用Q-RINEPT和zgig45序列测定的大豆油中主要脂肪酸含量
Table 4
| 样品 | 油酸(mol%) | 亚油酸(mol%) | 亚麻酸(mol%) | 饱和脂肪酸(mol%) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Q-RINEPT | zgig45 | Q-RINEPT | zgig45 | Q-RINEPT | zgig45 | Q-RINEPT | zgig45 | ||||
| 1 | 22.0 | 21.6 | 53.8 | 53.2 | 6.2 | 6.2 | 18.0 | 19.0 | |||
| 2 | 19.2 | 19.0 | 54.2 | 53.3 | 9.2 | 8.8 | 17.4 | 18.9 | |||
| 3 | 21.5 | 21.5 | 53.0 | 53.3 | 6.4 | 6.0 | 19.1 | 19.2 | |||
大豆油含有的主要脂肪酸包括油酸、亚油酸和亚麻酸等不饱和脂肪酸,以及棕榈酸、硬脂酸等饱和脂肪酸.文献中[14,31,32]采用1H NMR和13C NMR定量分析了大豆油的主要脂肪酸含量,其中油酸、亚油酸和亚麻酸的平均含量分别为21.3%、53.5%和7.2%,饱和脂肪酸约占18 %.从表4可以看出,采用Q-RINEPT方法测定的主要脂肪酸含量与常规的定量13C NMR测试的结果基本一致.但Q-RINEPT所用的测试时间更少.因此,Q-RINEPT方法可以快速可靠地测定植物油中主要脂肪酸含量,为植物油中脂肪酸含量的测定提供了一种新方法.Li等人[14]采用J-Selective QDEPT方法测量了植物油脂肪酸含量.该方法根据脂肪酸中JCH的分布(CH: 144~165 Hz; CH2: 120~134 Hz和143~154 Hz; CH3: 120~132 Hz)进行针对性优化,相对于反门控去耦13C NMR谱,可使13C 信号平均获得2.5倍增强.而Q-RINEPT方法由于针对的JCH范围更宽一些,在极化转移的特异性方面要差一点,因此信号增强效果要弱于J-Selective QDEPT.在下一步的工作中,可以针对特定体系JCH的分布,优化Q-RINEPT中的极化时间参数集,以提升信号增强效果.
Q-RINEPT方法可以进一步推广应用到更复杂的有机化合物体系中,克服常规定量13C NMR检测时间长、效率低的缺点.环氧乙烷/环氧丙烷聚醚多元醇广泛应用于聚酯工业中,其分子结构和分子量直接影响到高聚物制品的性能,需要对其详细表征[37].Q-RINEPT可以代替常规定量13C NMR,测定聚醚多元醇中环氧乙烷和环氧丙烷的摩尔比、环氧乙烷的含量、伯/仲羟基的摩尔比以及计算聚醚的相对分子质量.还可以将其应用到乙烯-丁烯共聚物单体含量、三元橡胶各组分以及原油中烃类含量的测定.并且可以根据具体研究体系,进行针对性优化,进一步提高Q-RINEPT实验中信号强度和检测准确度.
3 结论
本文提出了一种基于模拟退火优化的Q-RINEPT方法.采用模拟退火算法优化得到极化转移和重聚时间参数集,使不同基团的13C核获得相对均一的极化增强,实现重聚INEPT的定量测量和定量谱编辑.采用青蒿素、辛伐他丁等模型化合物对上述方法进行了验证,应用Case I极化时间参数集定量积分的相对标准偏差分别为1.6%和3.3%.将其应用到大豆油主要脂肪酸含量的测定中,结果与常规定量13C NMR测试相符,但所用时间显著较少.Q-RINEPT方法的脉冲序列简单,易于执行,优化得到的极化时间参数集适用于大多数有机化合物,为有机样品进行定量的13C NMR检测提供了新的有效途径.
致谢
感谢“中国科学院仪器设备功能开发技术创新项目(2017g0105)”对本研究的支持.
利益冲突
无
参考文献
A review of high resolution liquid 13carbon nuclear magnetic resonance characterzations of ethylene-based polymers
[J].DOI:10.1080/07366578908055172 URL [本文引用: 1]
13C NMR metabolomics: applications at natural abundance
[J].DOI:10.1021/ac502346h URL [本文引用: 1]
13C NMR spectroscopy for the quantitative determination of compound ratios and polymer end groups
[J].
DOI:10.1021/ol403776k
PMID:24601654
[本文引用: 1]

(13)C NMR spectroscopic integration employing short relaxation delays was evaluated as a quantitative tool to obtain ratios of diastereomers, regioisomers, constitutional isomers, mixtures of unrelated compounds, peptoids, and sugars. The results were compared to established quantitative methods such as (1)H NMR spectroscopic integration, gas chromatography, and high-performance liquid chromatography and were found to be within <3.4% of (1)H NMR spectroscopic values (most examples give results within <2%). Acquisition of the spectra took 2-30 min on as little as 10 mg of sample, proving the general utility of the technique. The simple protocol was extended to include end group analysis of low molecular weight polymers, which afforded results in accordance with (1)H NMR spectroscopy and matrix-assisted laser desorption-ionization time-of-flight spectrometry.
Distortionless enhancement of nmr signals by polarization transfer
[J].
The DEPT experiment and some of its useful variants
[J].
Enhancement of nuclear magnetic resonance signals by polarization transfer
[J].DOI:10.1021/ja00497a058 URL [本文引用: 1]
Net polarization transfer via a J-ordered state for signal enhancement of low-sensitivity nuclei
[J].
Quantitative 2D HSQC (Q-HSQC) via suppression of J-dependence of polarization transfer in NMR spectroscopy: application to wood lignin
[J].DOI:10.1021/ja029035k URL [本文引用: 1]
Sensitivity-enhanced quantitative 13C NMR spectroscopy via cancellation of 1JCH dependence in DEPT polarization transfers
[J].DOI:10.1021/ja039261+ URL [本文引用: 1]
Optimized quantitative dept and quantitative pommie experiments for 13C NMR
[J].DOI:10.1021/ac8015455 URL [本文引用: 1]
Optimization for sensitivity-enhanced quantitative 13C NMR experiment by genetic algorithm
[J].
用遗传算法优化灵敏度增强的定量13C NMR实验
[J].
Elimination of spectral distortion in polarization transfer experiments. improvements and comparison of techniques
[J].
Distortionless quantitative 13C DEPT++ experiment
[J].
Quantitative determination of fatty acid compositions in edible oils using J-Selective 13C QDEPT
[J].DOI:10.1007/s12161-019-01432-8 [本文引用: 3]
Quantitative 13C NMR spectroscopy using refocused constant-time INEPT, Q-INEPT-CT
[J].DOI:10.1016/j.jmr.2010.02.015 URL [本文引用: 1]
Fast and accurate quantification using genetic algorithm optimized 1H-13C refocused constant-time INEPT
[J].DOI:10.1016/j.jmr.2013.06.013 URL [本文引用: 1]
Robust and quantitative analysis of polyolefins using sensitivity-enhanced 13C NMR spectroscopy
[J].DOI:10.1021/acs.macromol.7b00193 URL [本文引用: 1]
Quantitative adiabatic-refocused INEPT (QA-RINEPT) as a tool for fast and reliable characterization of polyols
[J].DOI:10.1002/mrc.v56.12 URL [本文引用: 1]
Experimental demonstration of wideband spin inversion
[J].
Definitive 1H- and 13C-NMR assignments of artemisinin (qinghaosu)
[J].DOI:10.1021/np50060a040 URL [本文引用: 1]
Spectral data analysis and identifiication of simvastatin
[J].
辛伐他汀的波谱学数据和结构确证
[J].
Determination of plant oils by 1H and 13C NMR
[J].
植物油的1H NMR和13C NMR的测定
[J].
1H and 13C NMR of virgin olive oil. an overview
[J].DOI:10.1002/(ISSN)1097-458X URL [本文引用: 1]
Olive oil characterization and classification by 13C NMR with a polarization transfer technique: A comparison with gas chromatography and 1H NMR
[J].DOI:10.1016/j.foodchem.2017.12.005 URL [本文引用: 2]
Quantitative analysis of fatty acids and water in vegetable oils by nuclear magnetic resonance
[J].
DOI:10.7506/spkx1002-6630-201416041
[本文引用: 2]

采用核磁共振波谱分析技术,归属了植物油中亚麻酸、亚油酸、油酸等不饱和脂肪酸甘油酯、饱和脂肪酸甘油酯及水的核磁共振质子谱的主要特征峰。在无需预处理条件下,以苯甲酸作为内标,对植物油中各种脂肪酸及水进行定量分析,加标回收率可达98%~102%。亚麻酸、亚油酸、油酸、总饱和脂肪酸、水的精密度分别为0.11%、0.12%、0.68%、0.70%、2.65%。该法取样量少、无需昂贵的标样,可直接快速定量,结果准确,可为植物油的质量标准研究提供一种简单可行的新方法。
利用核磁共振法定量分析植物油中多种脂肪酸及水含量
[J].
DOI:10.7506/spkx1002-6630-201416041
[本文引用: 2]

采用核磁共振波谱分析技术,归属了植物油中亚麻酸、亚油酸、油酸等不饱和脂肪酸甘油酯、饱和脂肪酸甘油酯及水的核磁共振质子谱的主要特征峰。在无需预处理条件下,以苯甲酸作为内标,对植物油中各种脂肪酸及水进行定量分析,加标回收率可达98%~102%。亚麻酸、亚油酸、油酸、总饱和脂肪酸、水的精密度分别为0.11%、0.12%、0.68%、0.70%、2.65%。该法取样量少、无需昂贵的标样,可直接快速定量,结果准确,可为植物油的质量标准研究提供一种简单可行的新方法。
Simultaneous determination of fatty acids at sn-1,3 and sn-2 of triglyceride in edible oils by quantitative 13C-nuclear magnetic resonance
[J].
定量核磁共振碳谱同时测定食用油中甘油三酯的sn-1,3和sn-2脂肪酸含量
[J].
A strategy for simultaneous determination of fatty acid composition, fatty acid position, and position-specific isotope contents in triacylglycerol matrices by 13C-NMR
[J].DOI:10.1007/s00216-016-0005-z URL [本文引用: 2]
Fatty acid composition of vegetable oils determined from 13C-NMR spectra
[J].
13C NMR spectroscopy for determining the acylglycerol positional composition of lampante olive oils. Chemical shift assignments and their dependence on sample concentration
[J].DOI:10.1039/c0ay00028k URL [本文引用: 1]
A novel approach to the rapid assignment of 13C NMR spectra of major components of vegetable oils such as avocado, mango kernel and macadamia nut oils
[J].DOI:10.1002/mrc.v47:9 URL [本文引用: 1]
Application of NMR in structural characterization of polyether polyols
[J].
NMR在聚醚多元醇结构表征中的应用
[J].