引言
近年来,随着设备开发和技术进步,蛋白质结构生物学取得了跨越式发展.如同步辐射光源提供可调波长的稳定强光,可大大提高X-射线晶体衍射解析蛋白结构的效率;直接电子探测器的发明和图像处理技术的发展,使得利用冷冻电镜解析蛋白质结构的方法进入到原子分辨率水平.然而,仅解析静态三维结构无法完美地解释大多数蛋白质的分子机制和生物学作用.蛋白质在行使功能时同时存在多种构象,不同构象的相互转化实现了诸如酶催化、配体识别、信号传递和生物分子机器组装等重要生命活动[1].核磁共振(nuclear magnetic resonance,NMR)是获得原子分辨率蛋白质结构信息的三种主要方法之一,除了高分辨率结构解析外,NMR还可用以获得蛋白质在常温近生理条件下的动力学信息,这些动态变化过程也是绝大多数蛋白质行使功能的重要途径.结合特殊的选择性同位素氨基酸残基标记方案和先进的数据采集分析方法,液体NMR可研究的蛋白质的分子量上限也因此成倍增加.但在超大蛋白体系中,仍然存在NMR谱峰过多、谱峰展宽、分辨率较低的情况,从而影响构象信息的进一步获取.
在蛋白质关键位点引入非天然氨基酸,通过观测非天然氨基酸标记在蛋白质中的NMR信号,可获得蛋白质在相关生命活动中的构象变化.自然界中氢原子和氟原子的旋磁比大、NMR信号强,是比较理想的NMR观测对象.氟原子在生物分子结构中极少存在,无观测背景信号,是理想的NMR观测探针.而氢原子NMR信号更强,但蛋白质中氢原子多,需设计特殊官能团,以使得非天然氨基酸上待观测氢原子的化学位移与蛋白质上氢原子化学位移的分布存在显著差异;或利用相邻原子的同位素标记,通过选择性相关谱获得特殊标记位置的氢原子信号.非天然氨基酸标记的方法已成功运用到抗菌肽、膜蛋白、病毒衣壳等等蛋白的研究中.
本文将简要概括近年来常用的非天然氨基酸的标记方法,包括蛋白质化学合成法、蛋白质化学修饰法、氟代芳香族氨基酸插入和基因密码子编辑的位点特异性插入的生物合成法等,以及这些方法在蛋白质研究中的应用.
1 非天然氨基酸标记方法
1.1 肽链化学合成法
图1
图1
在蛋白质中引入非天然氨基酸的标记方法.红色为核磁共振可检测的氨基酸或原子核,蓝色为天然非标记氨基酸
Fig.1
Unnatural amino acids (UAA) labeling strategies for proteins. NMR active nuclei or residues are shown in red, and the other unlabeled natural residues are shown in blue
肽链的化学合成具有很高的灵活性,可在肽链中插入多种多个非天然氨基酸.此方法多运用于抗菌肽以及毒素多肽等小分子量蛋白质的研究中.虽然清华大学刘磊教授课题组[5]发展了酰肼连接法,将化学方法合成肽链的长度延长到近五百个氨基酸残基,但大分子量蛋白的正确折叠仍然是巨大的挑战,这也限制了化学合成方法在大蛋白质研究中的广泛应用.
1.2 氨基酸残基侧链化学修饰法
1.3 类天然氨基酸插入的生物合成法
若非天然氨基酸与天然氨基酸在结构和化学性质方面极其相似,如个别氢原子被替换成氟原子,此非天然氨基酸仍可被细胞内的氨酰tRNA合酶识别,将其插入到细胞合成的蛋白质中.将芳香族氨基酸芳环上的氢原子替换成氟原子,对其空间结构和化学性质影响较小,使得生物合成法成为可能.常用于此方法的非天然氨基酸包括3F-苯丙氨酸(Phe)[11]、4F-苯丙氨酸(Phe)[12]、3F-酪氨酸(Tyr)[13]、5F-色氨酸(Trp)[14]和6F-Trp[15]等等.草甘膦(glyphosate)可抑制芳香族氨基酸的合成,在无机细胞培养基中加入草甘膦和芳香族非天然氨基酸,即可在重组表达的蛋白质中高效引入这些非天然氨基酸[16] [图 1(c)].
1.4 基因密码子编辑的位点特异性插入的生物合成法
核酸中的四种碱基构成64种三联密码子,其中61种密码子编码20种天然氨基酸.另外的三种密码子不编码氨基酸,其中琥珀密码子作为终止密码的使用频率极低.M. jannaschii菌中编码酪氨酸的氨酰tRNA合酶对tRNA识别结构域较小,密码子结合区域缺失,所以对密码子的改变不敏感[17].因此可修改tRNA上识别三联密码子的配对碱基,实现对琥珀密码子的识别.同时修改氨酰tRNA合酶的氨基酸识别结构域,通过筛选获得正交氨酰tRNA合酶/tRNA对,实现利用琥珀密码子编码非天然氨基酸的目的[18].最终在重组表达目的蛋白的细胞中导入所改造的tRNAUAG及氨酰tRNAUAG合酶基因,即可在蛋白质特定位点实现非天然氨基酸的定点插入,最终获得单一氨基酸位点的信号,无需进一步信号归属[图 1(d)].
2 非天然氨基酸在大分子量蛋白质NMR研究中的应用实例
2.1 氨基酸残基侧链化学修饰法的应用
蛋白质中还原性半胱氨酸侧链化学活性较高、易被修饰,常被用于连接含氟基团用于NMR检测.目前国际上已有多个课题组将含有CF3基团的化合物,如TFET、BTFA、BTFMA,连接到蛋白质中,应用NMR线宽分析、饱和转移等实验方法进行蛋白质的功能状态分布和交换速率等动态特性检测.另外,13CH3标记的赖氨酸和13CH3标记的甲硫氨酸也广泛应用到蛋白质的构象变化分析中.
诺贝尔奖获得者Kurt Wuthrich课题组[6, 19]通过二硫键将TFET定点引入到G蛋白偶联受体-β2肾上腺素受体(β2AR)中,β2AR既可以偶联G蛋白,也可以结合β-arrestin蛋白.应用TFET定点19F标记方法分析了不同类型配体对β2AR的调节作用.激动剂的结合会使受体跨膜螺旋VI的构象朝G蛋白激活的状态移动,而β-arrestin偏向的配体结合会对受体跨膜螺旋VII的构象变化产生影响.这一标记方法也成功应用在A2A腺苷受体(A2AAR),以及在糖代谢和糖尿病发病机制中发挥重要作用的胰高血糖素样肽受体(GLP-1R)和胰高血糖素受体(GCGR)上.Wang等[20]运用19F NMR方法动态揭示了A2AAR不同构象状态的动态集合,并测定了不同构象状态间的交换速率,同时分析了变构调节剂NAM NNC0640对GLP-1R的变构调控作用.
北京大学金长文教授课题组[21]与Brian Lobilka教授合作,应用13C标记的甲醛与赖氨酸反应标记β2AR,研究了β2AR对下游信号分子Gs和Gi蛋白的选择性构象变化.该研究分别采集了β2AR各赖氨酸标记位点在反向激动剂卡拉洛尔(carazolol)、无配体结合状态(apo)、激动剂BI167107结合状态以及激动剂BI167107和G蛋白同时结合状态的1H-13C HSQC谱图,根据NMR波谱分析,激动剂BI167107稳定的受体构象状态与结合了下游G蛋白的构象状态不同.β2AR的胞内第二个loop环(ICL2)偶联Gs和Gi后构象发生显著差异.受体的ICL2在与Gs的激活作用中起到关键作用,是决定下游信号通路(Gs和Gi)选择性的关键因素.
相比传统的NMR标记方法,氨基酸侧链标记在研究大分子量蛋白质,尤其是膜蛋白的动态特性方面有独特的优势,很大程度上简化了NMR谱图,方便了NMR信号的归属,并能够针对性的对某些氨基酸位点进行动态性质分析.
2.2 类天然氨基酸插入的生物合成法的应用
含氟的芳香族类似物对蛋白质构象扰动较小,能够进行蛋白质中多位点的19F引入,但由于19F原子在苯环上运动受限,含氟的芳香族氨基酸类似物在大分子量蛋白质的动态分析应用中有一定局限.
2.3 基因密码子编辑的位点特异性插入法的应用
三氟甲基苯丙氨酸(tfmF)是最早通过扩展基因密码子方法引入蛋白质并运用NMR研究的非天然氨基酸,它能够被特异性引入到蛋白质的特定位点,实现蛋白质的位点特异性动态特性分析.基因密码子扩展目前也是应用最广泛的非天然氨基酸定点引入方法,已受到国内外很多研究者的关注.中国科学技术大学田长麟课题组应用19F-标记的tfmF实现蛋白质的定点同位素标记,并结合NMR方法研究了大分子量蛋白质、蛋白质复合物或膜蛋白在不同功能状态下的结构与功能关系,包括水溶性蛋白vinexin SH3结构域和膜蛋白DAGK的19F定点标记和动力学分析[28, 29],膜蛋白DAGK的溶剂暴露行为[30];并利用位点19F特异性非天然氨基酸标记结合19F弛豫增强实验对多结构域蛋白的构象辨认[31];应用19F位点特异性标记和固体NMR相结合的技术对膜蛋白DAGK进行了研究[32].
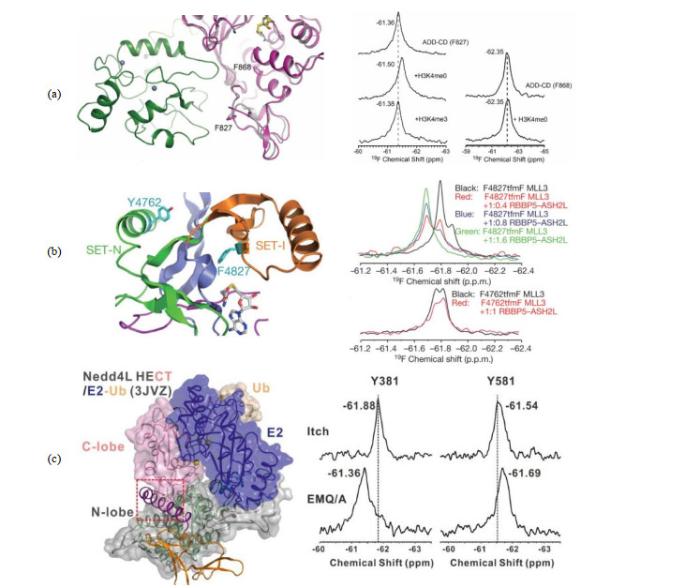
tfmF在表观遗传相关蛋白质的NMR研究中也有重要作用.蛋白质构象变化及动态特性对DNA甲基化修饰的功能阐述起着至关重要的作用.田长麟课题组与徐彦辉课题组合作通过tfmF定点标记方法,分析了与多种癌症密切相关的甲基转移酶DNMT3A蛋白多个不同位点在甲基化或非甲基化组蛋白H3片段存在情况下的NMR波谱,确认了DNMT3A蛋白只受非甲基化H3蛋白的功能调控[图 2(a)][33].MLL家族蛋白(MLL1/2/3/4,SET1A/B)是一类特异性针对H3K4的甲基转移酶,需要多个辅助蛋白WDR5、RBBP5、ASH2L组成复合体行使功能.田长麟课题组与雷鸣课题组合作应用19F非天然氨基酸定点标记和NMR方法分析得知RBBP5-ASH2L能够显著地使MLL SET-I结构固定在一种活性构象,这种活性构象有利于底物和辅因子的结合,从而增强MLL的甲基转移酶活性[图 2(b)][34].Nedd4家族E3连接酶是细胞生长和增殖的关键调节因子,并且在人类癌症和其他疾病中经常被错误调节.Nedd4 E3s的连接酶活性通过自身抑制严格控制.然而,人们对Nedd4 E3自身抑制和激活的分子机制知之甚少.田长麟课题组与温文玉课题组合作应用19F非天然氨基酸定点标记和NMR方法协助分析了Nedd4家族E3链接酶Itch自抑制激活机制[图 2(c)][35].
图2
图2
一维19F NMR数据显示(a)组蛋白H3末端诱导DNMT3A蛋白发生构象变化[33],(b) MLL3SET受RBBP5-ASH2L激活引起构象变化[34],以及(c) Nedd4家族E3链接酶Itch自抑制激活机制[35]
Fig.2
1D 19F NMR spectra were used for investigation of (a) DNMT3A conformation change on histone H3 binding[33], (b) MLL3SET conformation change activated by RBBP5-ASH2L[34], and (c) the Nedd4 family E3 ligase Itch auto-inhibition and activation[35]
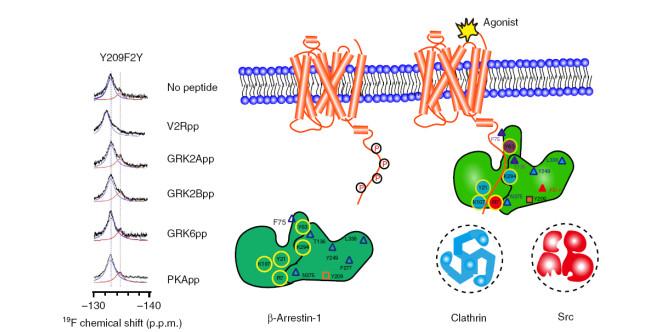
G蛋白偶联的受体可以通过G蛋白或者Arrestin介导信号通路,研究发现不同的Arrestin构象也与不同的下游蛋白相偶联,将胞外刺激转化为胞内信号.王江云课题组与田长麟课题组合作运用19F NMR及非天然氨基酸定点插入的方法,研究得知Arrestin可以通过N端磷酸化位点来识别特异的受体磷酸化条形码,并产生特异性的构象变化,从而选择不同下游蛋白信号通路,并提出了受体磷酸化编码“笛子模型”[36](图 3).王江云研究员和孙金鹏教授合作发展了4-三甲基硅基苯丙氨酸(TMSiPhe)的非天然氨基酸特异性标记方法(DeSiPher),应用晶体学揭示了非天然氨基酸氨酰合酶对TMSiPhe的选择性识别机制.利用TMSiPhe特有的1H NMR化学位移和灵敏度,检测了不同配体结合GPCR后调控下游蛋白arrestin的多重构象状态[37],并应用DeSiPher技术说明了GPCR单磷酸化位点缺陷可引起arrestin远端功能结构域的构象变化[38].
图3
氟原子在生物体中的丰度极低,没有背景氟原子信号,因此氟原子可作为细胞内原位检测的高效NMR探针.中国科学技术大学田长麟课题组还运用19F tfmF实现了大分子量膜蛋白的原位NMR分析.大肠杆菌酪氨酸激酶(E. coli tyrosine kinase,ETK)是一个含有两个跨膜螺旋和胞内一段可溶性激酶催化结构域的膜蛋白(图 4).应用位点特异性非天然氨基酸标记方法在ETK的活性位点引入F2-Tyr,并在蛋白质不用纯化的情况下,加入聚苯乙烯马来酸酐(styrene maleic acid,SMA)化合物形成纳米尺寸的磷脂盘结构(lipodisq),应用超高速魔角旋转的固体19F NMR方法,原位测定ETK的磷酸化[39].在大肠杆菌中也实现了细胞有丝分裂中重要激酶MEKK3、MEK5的共表达和多位点19F标记,在细胞裂解液条件下获得两个蛋白的原位19F NMR光谱,并分析了蛋白质复合物界面[40].
图4
通过基因密码子编辑的非天然氨基酸定点引入方法在大分子量蛋白质的动态分析中发挥巨大的作用,能够在特定蛋白质的特定位点进行非天然氨基酸标记,得到简化的NMR图谱,从而进行蛋白质特定结构域、特定功能区的动态特性研究.目前国际上越来越多的课题组将基因密码子扩展技术从原核细胞体系逐步发展到真核细胞表达体系中,应用基因密码子编辑的非天然氨基酸定点引入方法将有越来越复杂的蛋白质机器能够进行非天然氨基酸标记.
3 非天然氨基酸在蛋白质NMR研究中的应用展望
3.1 标记方法的发展
尽管非天然氨基酸标记已成功运用在大蛋白体系的研究中,但各种标记方法均存在自己的短板.化学合成大蛋白效率低、成本极高;化学修饰的效率受蛋白质构象和空间位阻影响,蛋白核心区修饰效率较低.生物合成方式克服了上述两个缺点,成本低、标记稳定性高.基于拓展密码子编码的非天然氨基酸插入技术更是大大提高了引入位点的特异性.但目前基于生物合成插入的非天然氨基酸主要是芳香族氨基酸类似物,还没有可靠的其他类别的氨基酸插入方法.蛋白与底物和配体的结合不仅仅靠芳香氨基酸的相互作用,更多的氢键、盐键需要亲水氨基酸和带电氨基酸的参与.因此,应当发展更多类别的探针,适用于不同类别氨基酸的残基的研究,减少对蛋白功能的影响.同时提高非天然氨基酸插入效率,实现多位点、不同种类非天然氨基酸的插入,提高单个样品提供的信息量,同时降低样品制备成本.
3.2 与高转速魔角旋转固体NMR方法的结合
非天然氨基酸标记可显著减少大分子量蛋白中的可观测信号个数,大大降低信号归属难度.但随着蛋白质分子量变大,蛋白质分子在溶液中的自由翻滚变慢.原子间的偶极耦合(ΗD ~ [3cos2θ − 1]*r−3)不能及时被完全平均掉,导致谱线变宽.即使通过非天然氨基酸标记方法,减少了信号数目,但信号仍然仍会变宽减弱.魔角旋转固体NMR方法让样品绕与静磁场54.7˚ 的轴高速旋转,使得(3cos2θ − 1)因子为0,从原理上突破样品分子量的限制,只受魔角转速的影响.只要旋转角速度足够大即可有效平均偶极耦合和化学位移各向异性对核磁信号的影响[41].因此可用于超大蛋白分子机器特定位点的观测,进一步可实现细胞原位环境中的观测.
麻省理工的Mei Hong研究组的研究结果表明,20~40 kHz的中低魔角转速条件下即可有效平均19F原子的化学位移各向异性,以及周围氟原子或氢原子对其偶极相互作用,获得高分辨率19F NMR谱图,实现高效的氟原子同核或异核之间的磁化传递[42, 43].蛋白质中氢原子密度高,偶极相互作用强,目前商用魔角探头最大转速为111 kHz,已能有效观测蛋白质主链区域氢的信号,但蛋白质侧链氢原子密度大,尤其是甲基氢原子信号分辨率仍然较低[44].受限于音障,更高的转速需要设计更小的转子,样品仓体积只能设计的更小,限制了信号强度.目前转速可达111 kHz的0.7 mm转子,样品仓体积仅0.3 μL.为了平衡高分辨率对高魔角转速的要求和高信号强度对转子内样品总量的要求,可设计合成氘代非天然氨基酸,结合蛋白质的氘代方法,可在较低魔角转速下获得高分辨氢谱.
参考文献
Dynamic personalities of proteins
[J].DOI:10.1038/nature06522 [本文引用: 1]
Solid phase peptide synthesis. I. the synthesis of a tetrapeptide
[J].DOI:10.1021/ja00897a025 [本文引用: 1]
Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation
[J].DOI:10.1021/jo00044a001 [本文引用: 1]
The renascence of continuous-flow peptide synthesis-an abridged account of solid and solution-based approaches
[J].DOI:10.1039/C7OB02759A [本文引用: 1]
Protein chemical synthesis by ligation of peptide hydrazides
[J].DOI:10.1002/anie.201100996 [本文引用: 1]
Biased signaling pathways in beta2-adrenergic receptor characterized by 19F-NMR
[J].DOI:10.1126/science.1215802 [本文引用: 2]
Oxygen as a paramagnetic probe of membrane protein structure by cysteine mutagenesis and 19F NMR spectroscopy
[J].DOI:10.1021/ja016748e [本文引用: 1]
Position-dependent effects of fluorinated amino acids on the hydrophobic core formation of a heterodimeric coiled coil
[J].DOI:10.1002/chem.200802136 [本文引用: 1]
Protein 19F-labeling using transglutaminase for the NMR study of intermolecular interactions
[J].DOI:10.1007/s10858-017-0125-6 [本文引用: 1]
Lysine methylation strategies for characterizing protein conformations by NMR
[J].DOI:10.1007/s10858-012-9664-z [本文引用: 1]
19F NMR studies of the D-galactose chemosensory receptor. 1. Sugar binding yields a global structural change
[J].DOI:10.1021/bi00231a021 [本文引用: 1]
NMR studies of 4-19F-phenylalanine-labeled intestinal fatty acid binding protein: evidence for conformational heterogeneity in the native state
[J].DOI:10.1021/bi047600l [本文引用: 1]
A residual structure in unfolded intestinal fatty acid binding protein consists of amino acids that are neighbors in the native state
[J].DOI:10.1021/bi052091o [本文引用: 1]
Interaction of the eukaryotic pore-forming cytolysin equinatoxin Ⅱ with model membranes: 19F NMR studies
[J].DOI:10.1016/j.jmb.2004.12.058 [本文引用: 1]
Real-time and equilibrium 19F-NMR studies reveal the role of domain-domain interactions in the folding of the chaperone PapD
[J].DOI:10.1073/pnas.022649599 [本文引用: 1]
19F NMR investigation of F(1)-ATPase of Escherichia coli using fluorotryptophan labeling
[J].DOI:10.1093/oxfordjournals.jbchem.a022697 [本文引用: 1]
Crystal structures of apo wild-type M. jannaschii tyrosyl-tRNA synthetase (TyrRS) and an engineered TyrRS specific for O-methyl-L-tyrosine
[J].DOI:10.1110/ps.041239305 [本文引用: 1]
An enhanced system for unnatural amino acid mutagenesis in E. coli
[J].DOI:10.1016/j.jmb.2009.10.030 [本文引用: 1]
beta(2)-adrenergic receptor activation by agonists studied with 19F NMR spectroscopy
[J].DOI:10.1002/anie.201305286 [本文引用: 1]
Design and preparation of the class B G protein-coupled receptors GLP-1R and GCGR for 19F-NMR studies in solution
[J].DOI:10.1111/febs.15686 [本文引用: 1]
Analysis of beta2AR-Gs and beta2AR-Gi complex formation by NMR spectroscopy
[J].DOI:10.1073/pnas.2009786117 [本文引用: 1]
Calculation of fluorine chemical shift tensors for the interpretation of oriented 19F-NMR spectra of gramicidin A in membranes
[J].DOI:10.1039/b908236k [本文引用: 1]
19F NMR studies of the native and denatured states of green fluorescent protein
[J].DOI:10.1021/ja060618u [本文引用: 1]
Tryptophan solvent exposure in folded and unfolded states of an SH3 domain by 19F and 1H NMR
[J].DOI:10.1021/bi061389r [本文引用: 1]
Direct observation of Ca2+-induced calmodulin conformational transitions in intact Xenopus laevis oocytes by 19F NMR spectroscopy
[J].DOI:10.1002/anie.201500261 [本文引用: 1]
Quantification of size effect on protein rotational mobility in cells by 19F NMR spectroscopy
[J].DOI:10.1007/s00216-017-0745-4 [本文引用: 1]
Site-specific protein backbone and side-chain NMR chemical shift and relaxation analysis of human vinexin SH3 domain using a genetically encoded 15N/19F-labeled unnatural amino acid
[J].DOI:10.1016/j.bbrc.2010.10.046 [本文引用: 1]
Site-specific 19F NMR chemical shift and side chain relaxation analysis of a membrane protein labeled with an unnatural amino acid
[J].
Site-specific solvent exposure analysis of a membrane protein using unnatural amino acids and 19F nuclear magnetic resonance
[J].DOI:10.1016/j.bbrc.2011.09.082 [本文引用: 1]
Intracellular segment between transmembrane helices S0 and S1 of BK channel alpha subunit contains two amphipathic helices connected by a flexible loop
[J].DOI:10.1016/j.bbrc.2013.06.091 [本文引用: 1]
In situ 19F NMR studies of an E. coli membrane protein
[J].DOI:10.1002/pro.2040 [本文引用: 1]
Structural insight into autoinhibition and histone H3-induced activation of DNMT3A
[J].DOI:10.1038/nature13899 [本文引用: 3]
Structural basis for activity regulation of MLL family methyltransferases
[J].DOI:10.1038/nature16952 [本文引用: 3]
Allosteric auto-inhibition and activation of the Nedd4 family E3 ligase Itch
[J].DOI:10.15252/embr.201744454 [本文引用: 3]
Phospho-selective mechanisms of arrestin conformations and functions revealed by unnatural amino acid incorporation and 19F NMR
[J].DOI:10.1038/ncomms9202 [本文引用: 3]
DeSiphering receptor core-induced and ligand-dependent conformational changes in arrestin via genetic encoded trimethylsilyl 1H-NMR probe
[J].DOI:10.1038/s41467-020-18433-5 [本文引用: 1]
Structural studies of phosphorylation-dependent interactions between the V2R receptor and arrestin-2
[J].DOI:10.1038/s41467-021-22731-x [本文引用: 1]
Nano-size uni-lamellar lipodisq improved in situ auto-phosphorylation analysis of E. coli tyrosine kinase using 19F nuclear magnetic resonance
[J].DOI:10.1007/s13238-014-0129-x [本文引用: 3]
Protein-protein interaction analysis in crude bacterial lysates using combinational method of 19F site-specific incorporation and 19F NMR
[J].DOI:10.1007/s13238-016-0336-8 [本文引用: 1]
Magic angle spinning NMR spectroscopy: a versatile technique for structural and dynamic analysis of solid-phase systems
[J].DOI:10.1021/ac504288u [本文引用: 1]
Fast magic-angle-spinning 19F spin exchange NMR for determining nanometer 19F-19F distances in proteins and pharmaceutical compounds
[J].DOI:10.1021/acs.jpcb.8b00310 [本文引用: 1]
Rapid measurement of long-range distances in proteins by multidimensional 13C-19F REDOR NMR under fast magic-angle spinning
[J].DOI:10.1007/s10858-018-0187-0 [本文引用: 1]
Limits of resolution and sensitivity of proton detected MAS solid-state NMR experiments at 111 kHz in deuterated and protonated proteins
[J].DOI:10.1038/s41598-017-07253-1 [本文引用: 1]