引言
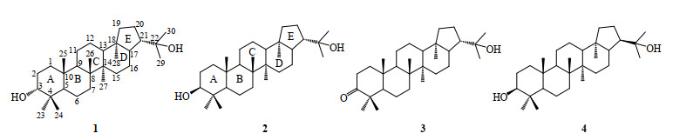
图1
本文在制备得到纯的化合物1和化合物2的基础上,利用X-射线单晶衍射(XRD)实验测得了化合物2的绝对构型,并完整归属了这两个化合物的1H NMR和13C NMR数据.
1 实验部分
1.1 化合物制备
起始原料化合物3从达玛树脂(Damar resin)中分离得到.根据文献[4]方法,化合物3溶于甲醇和二氧六环的混合溶剂,NaBH4作为还原剂,加热回流还原化合物3,得到的主产物为β-异构体(化合物2).然而,与文献[8]所述不同的是,快速柱色谱并不能分离纯化这两个异构体(化合物1和化合物2).此外,无论用甲醇做溶剂、NaBH4为还原试剂,还是四氢呋喃作溶剂、三异丁基硼氢化锂(L-selectride)为还原试剂,均不能得到单一构型化合物,两种方法得到的化合物1和化合物2的摩尔比分别为1:9和6:4(利用1H NMR谱图计算).鉴于两种异构体均需要进行1H和13C NMR归属,我们选择三异丁基硼氢化锂作为还原试剂来获得纯的化合物1和化合物2.
化合物1和化合物2的制备如图 2所示.将化合物3(221 mg,0.5 mmol)溶于2, 6-二甲基吡啶(2, 6-Lutidine,10 mL),冰浴下加入三乙基硅基三氟甲磺酸酯(TESOTf)2.6 mL(2.6 mmol),滴加完毕后室温搅拌3 h,经薄层色谱(TLC)检测反应完毕后,加水、乙酸乙酯萃取,硅胶柱分离得到化合物5(3-氧代-22-三乙基硅基何伯烷)(268 mg,96.2%).将化合物5(200 mg,0.36 mmol)溶于无水二氯甲烷(10 mL),-78 ℃加入三异丁基硼氢化锂2.0 mL(1.0 mol/L四氢呋喃溶液),低温下继续搅拌4 h,反应完毕后加水,二氯甲烷萃取,硅胶柱分离得到化合物6a(114 mg,56.6%)和6b(76 mg,37.8%).称取化合物6a(3α-羟基-22-三乙基硅基何伯烷)和6b(3β-羟基-22-三乙基硅基何伯烷)各56 mg(0.1 mmol)分别溶于10 mL四氢呋喃,室温下各加入四丁基氟化铵(TBAF)1 mL(1.0 mol/L四氢呋喃溶液),继续搅拌6 h,反应完毕后蒸干溶剂,加水和二氯甲烷萃取,硅胶柱色谱分离得到化合物1(39 mg,87.7%)和化合物2(40 mg,89.9%).
图2
1.2 XRD实验
为了确认化合物1和化合物2的绝对构型,以便正确归属两个化合物的1H和13C NMR数据,以二氯甲烷和甲醇作为结晶溶剂,得到了化合物2的无色、块状单晶(多次实验未能得到化合物1的单晶).选择0.20×0.18×0.15 mm3大小的晶体,在Agilent SuperNova Diffraction单晶衍射仪上,采用经石墨单色化的Cu Kα射线(λ=1.541 78 Å)进行测量,各衍射数据在293 K下收集.
1.3 NMR实验
样品溶于氘代吡啶(pyridine-d5),并以吡啶作为内标定标(δH 7.22,δC 123.9).1D和2D NMR实验均在配备OneNMR Probe探头的Agilent 400-MR型NMR谱仪上完成.1H NMR和13C NMR的工作频率分别为399.79 MHz和100.54 MHz,谱宽分别为4 006.4 Hz和25 000 Hz.2D谱包括NOESY和2D梯度场1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱,均采用标准脉冲程序.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为4 006.4 Hz,采样数据点阵t2×t1=1 024×256,累加次数为8;NOESY的F2(1H)和F1(1H)维谱宽均为2 800 Hz,采样数据点阵t2×t1=1 024×256,累加次数为16;HSQC的F2(1H)和F1(13C)维谱宽分别为6 410 Hz和20 100 Hz,采样数据点阵t2×t1=1 024×256,累加次数为16;HMBC的F2(1H)和F1(13C)维谱宽分别为3 788 Hz和16 084 Hz,采样数据点阵t2×t1= 1 024×512,累加次数为32.
2 结果与讨论
2.1 化合物2的单晶衍射数据分析
通过XRD实验进一步证实了3β, 22-二羟基何伯烷(化合物2)的立体化学结构,化合物2的透视图如图 3所示.该化合物的晶体学数据作为补充出版物(CCDC1868374)保存于剑桥晶体数据中心(Cambridge Crystallographic Data Centre,12 Union Road,Cambridge CB2 1EZ,UK),可以免费申请数据副本(E-mail: deposit@ccdc.cam.ac.uk).表 1中列出了化合物2的晶体数据和细节信息.XRD分析显示化合物2的晶体为单斜晶系,空间群为C2.四个六元碳环(A、B、C、D)均为椅式构象,而五元碳环(E)中C17、C19、C20和C21形成一个平面(平均偏差为0.029 6°),为信封式构象.O1-C3和O2-C22的键长分别为1.452(5) Å和1.542(7) Å(1 Å=0.1 nm).
图3
表1 化合物2的单晶数据
Table 1
| 分子式(Formula) | C30H52O2 |
| 分子量(Formula weight) | 444.73 |
| 温度(Temperature) | 293(2) K |
| λ (Cu K) | 1.54178 Å |
| 晶系(Crystal system) | 单斜晶系(Monoclinic) |
| 空间群(Space group) | C2 |
| 晶胞参数(Unit cell dimensions) | a=32.6725(12) Å, α=90° b=7.3866(2) Å, β=96.463(3)° c=11.0375(3) Å, γ=90° |
| 体积(Volume) | 2646.85(14) Å3 |
| 晶胞中最小不对称单元个数Z | 4 |
| 计算密度(Calculated Density) | 1.166 g·cm-3 |
| Reflections collected /unique | 6531/4142 |
| 吸收系数(Absorption coefficient) | 0.551 mm-1 |
| F(000) | 1036 |
| θ | 4.03° ~76.40° |
| 拟合优度(GOF) | 1.075 |
| 最终R指数(I > 2sigma(I))* | R1=0.0769, wR2=0.2114 |
* R1=∑||Fo|-|Fc||/∑|Fo|; wR2=[∑w(Fo2-Fc2)2/∑w(Fo2)2]1/2.
2.2 NMR谱图分析
2.2.1 化合物2的归属
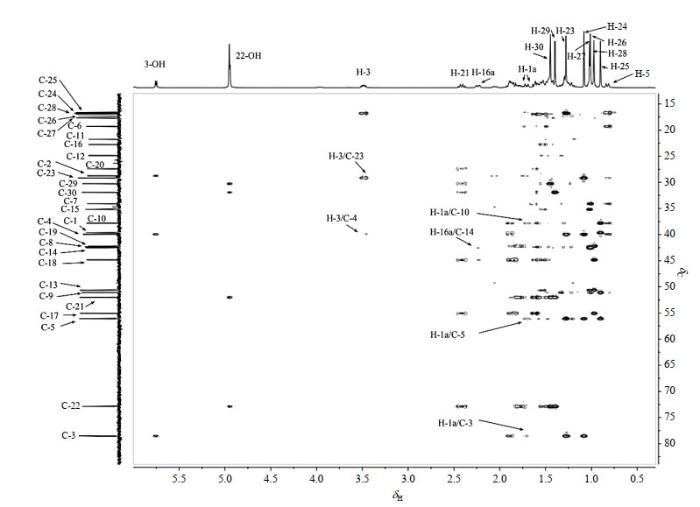
化合物2的1H NMR(图S1,可扫描文章首页OSID码或在文章网页版查看)谱中能够直接清晰辨认的有8个甲基和δH 0.82(1H,dd,J=11.4/1.9 Hz)、δH 2.24(1H,ddt,J=13.1/4.7/2.4 Hz)、δH 2.42(1H,dt,J=11.9/9.0 Hz)、δH 3.49(1H,dt,J=10.3/5.6 Hz)、δH 4.94(1H,s)、δH 5.75(1H,d,J=5.3 Hz)等六个质子.HSQC谱(图S2)显示δH 4.94(1H,s)和δH 5.75(1H,d,J=5.3 Hz)这两处质子为活泼氢(无相关信号),根据化学位移,结合1H-1H COSY(图S3)可归属δH 3.49(1H,dt,J=10.3/5.6 Hz)为H-3,δH 5.75(1H,d,J=5.3 Hz)为3-OH,δH 4.94(1H,s)为22-OH,结合HSQC谱归属δC 78.5(叔)为C-3.13C NMR谱(图S4)中显示化合物2有30个碳原子,DEPT谱(图S5)表明化合物2有8个伯碳、10个仲碳、6个叔碳和6个季碳.HMBC(图 4)谱中,H-3和δC 16.8(伯)、δC 29.2(伯)、δC 39.9(季),3-OH和C-3、δC 28.8(仲)、δC 39.9(季),22-OH和δC 30.3(伯)、δC 31.9(伯)、δC 52.0(叔)、δC 72.9(季)远程偶合相关,可准确归属C2 [δC 28.8(仲)]、C4 [δC 39.9(季)]、C21 [δC 52.0(叔)]、C22 [δC 72.9(季)];借助HSQC谱,以及H-3和H-23之间的NOE效应(图S6),H-2 [δH 1.89(2H,m)]、H-21 [δH 2.42(1H,dt,J=11.1/9.0 Hz)]、H-23 [δH 1.28(3H,s)]、H-24 [δH 1.08(3H,s)]、C-23 [δC 29.2(伯)]、C-24 [δC 16.8(伯)]也得到准确归属.借助于HMBC谱中与C-23和C-24的远程偶合相关信号,将1H NMR谱中最高场的质子δH 0.82(1H,dd,J=11.4/1.9 Hz)归属为H-5,结合HSQC谱可指认出C-5 [δC 56.1(叔)].HMBC谱显示,δC 16.6(伯)和H-5远程偶合相关,归属为C-25,借由HSQC谱图可知δH 0.90(3H,s)为H-25.接下来,借助于HMBC谱中H-25与C-1 [δC 39.6(仲)]、C-9 [δC 51.1(叔)]、C-10 [δC 37.8(季)]的远程偶合相关信号峰,可以准确归属C-1、C-9和C-10;通过HSQC谱中相关信号,可分别归属H-1 [δH 1.71(1H,dt,J=13.0/3.5 Hz)、δH 0.99(1H,m)]和H-9 [δH 1.30(1H,m)].A环的所有碳原子和质子信号得到归属.
图4
通过HMBC谱中H-21与C-17 [δC 55.1(叔)]、C-18 [δC 44.8(季)]、C-20 [δC 27.4(仲)]的远程偶合相关,结合HSQC谱,C-17、C-18、C-20以及H-17 [δH 1.53(1H,m)]和H-20 [δH 1.85(1H,m)、δH 1.78(1H,m)]得到相应归属.基于HMBC谱中δH 0.97(3H,s)与C-17和C-18的远程相关信号,将其归属为H-28,C-28 [δC 17.0(伯)]可通过HSQC谱图准确指认.借助于HMBC谱中与H-28相关的C-13 [δC 50.6(叔)]和C-19 [δC 42.2(仲)],结合HSQC谱,可归属C-13、C-19、H-13 [δH 1.46(1H,m)]和H-19 [δH 1.62(1H,m)、δH 1.03(1H,m)].E环的所有碳原子和质子信号得到归属.
HMBC谱中,δH 2.24(1H,ddt,J=13.1,4.7,2.4 Hz)与C-18和δC 42.6(季)远程偶合相关,HSQC谱中,该质子和δH 1.84(1H,m)与δC 22.8(仲)相关,NOESY谱中,δH 2.24(1H,ddt,J=13.1,4.7,2.4 Hz)与H-29和H-30相关,归属δH 2.24(1H,ddt,J=13.1/4.7/2.4 Hz)和1.84(1H,m)为H-16,δC 22.8(仲)为C-16,δC 42.6(季)为C-14.HMBC谱中,δH 1.02(3H,s)与C-13、C-14、δC 35.2(仲)和δC 42.4(季)远程偶合相关,归属δH 1.02(3H,s)为H-27,δC 35.2(仲)为C-15,δC 42.4(季)为C-8.结合HSQC谱,可准确归属C-27 [δC 17.7(伯)]、H-15 [δH 1.43(1H,m)、δH 1.29(1H,m)].D环归属完毕.
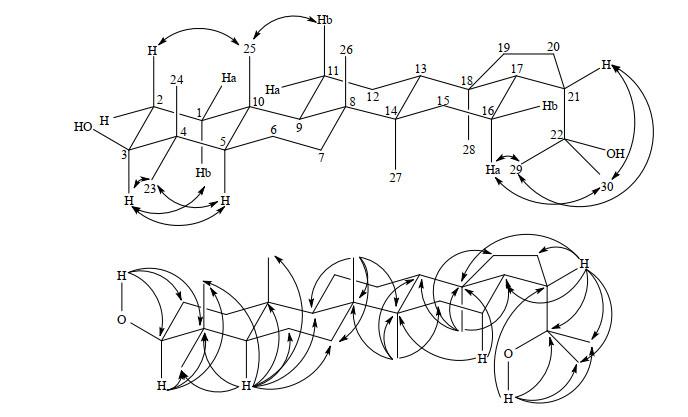
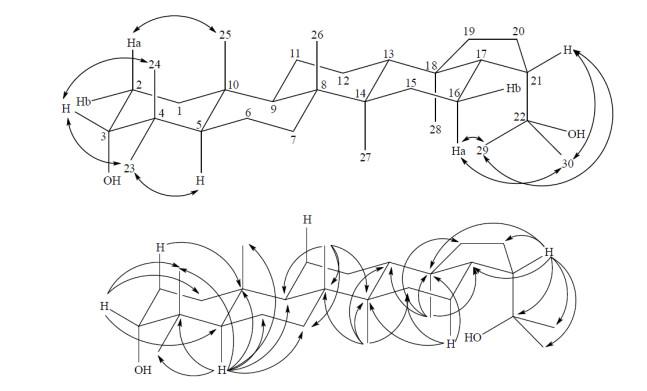
HMBC谱中,δH 1.01(3H,s)和C-8、C-9、C-14及δC 34.1(仲)远程偶合相关,归属δH 1.01(3H,s)为H-26,δC 34.1(仲)为C-7,结合HSQC谱可准确归属C-26 [δC 17.3(伯)]和H-7 [δH 1.46(1H,m)、δH 1.23(1H,m)].HMBC谱中显示H-5和C-4、C-7、C-9、C-10、C-23、C-24、C-25及δC 19.3(仲)远程偶合相关,归属δC 19.3(仲)为C-6,结合HSQC可归属H-6 [δH 1.61(1H,m)、δH 1.46(1H,m)],B环归属完毕.至此,仅余δH 1.54(1H,m)、δH 1.30(1H,m)、δC 21.8(仲)和δH 1.47(2H,m)、δC 24.9(仲)未归属.借助于NOESY谱中δH 1.30(1H,m)与H-25的相关信号,结合HSQC归属δH 1.54(1H,m)和δH 1.30(1H,m)为H-11,δC 21.8(仲)为C-11,则δH 1.47(2H,m)为H-12,δC 24.9(仲)为C-12.至此,所有数据归属完毕. 值得注意的是,H-29和H-30均与H-16、H-21这两组质子有NOE效应,表明C21-C22键在溶液中可以自由旋转,亦即H-29和H-30的化学位移可以互换.同样由于C21-C22键可以自由旋转,亦无法通过C-H远程偶合来准确归属C-29和C-30.HMBC和NOESY谱中的主要相关信号如图 5所示.
图5
图5
化合物2中主要的1H-13C远程偶合相关(→)和1H-1H NOE相关(↔)
Fig.5
Selected key 1H-13C heteronuclear multiple-bond connectivity (→) and 1H-1H NOESY correlations (↔) of compound 2
化合物2的所有1H NMR和13C NMR数据如表 2所示.
表2 化合物2的1H和13C NMR实验数据(溶剂:Pyridine-d5)和文献数据(溶剂:CDCl3)
Table 2
| No. | 实验 | 文献[3] CDCl3 | ||||||
| δH (J/Hz) | δC | HMBC | 1H-1H COSY | NOESY | δH (J/Hz) | δC | ||
| 1a | 1.71 (1H, dt, 13.0/3.5) | 39.6(仲) | C-3, 5, 10 | H-1b | ||||
| 1b | 0.99 (1H, m) | H-1a | H-3 | |||||
| 2 | 1.89 (2H, m) | 28.8(仲) | H-25 | |||||
| 3 | 3.49 (1H, dt, 10.3/5.6) | 78.5(叔) | C-4, 23, 24 | H-2, 3-OH | H-5, 23, 1b | |||
| 4 | / | 39.9(季) | ||||||
| 5 | 0.82 (1H, dd, 11.4/1.9) | 56.1(叔) | C-4, 6, 7, 9, 10, 23, 24, 25 | H-6 | H-3, 23 | |||
| 6a | 1.61 (1H, m) | 19.3(仲) | ||||||
| 6b | 1.46 (1H, m) | |||||||
| 7a | 1.46 (1H, m) | 34.1(仲) | ||||||
| 7b | 1.23 (1H, m) | |||||||
| 8 | / | 42.4(季) | ||||||
| 9 | 1.30 (1H, m) | 51.1(叔) | ||||||
| 10 | / | 37.8(季) | ||||||
| 11a | 1.54 (1H, m) | 21.8(仲) | ||||||
| 11b | 1.30 (1H, m) | H-25 | ||||||
| 12 | 1.47 (2H, m) | 24.9(仲) | ||||||
| 13 | 1.46 (1H, m) | 50.6(叔) | ||||||
| 14 | / | 42.6(季) | ||||||
| 15a | 1.43 (1H, m) | 35.2(仲) | ||||||
| 15b | 1.29 (1H, m) | |||||||
| 16a | 2.24 (1H, ddt, 13.1/4.7/2.4) | 22.8(仲) | C-14, 18 | H-15, 16b | H-29, 30 | |||
| 16b | 1.84 (1H, m) | H-15, 16a | ||||||
| 17 | 1.53 (1H, m) | 55.1(叔) | ||||||
| 18 | / | 44.8(季) | ||||||
| 19a | 1.62 (1H, m) | 42.2(仲) | ||||||
| 19b | 1.03 (1H, m) | |||||||
| 20a | 1.85 (1H, m) | 27.4(仲) | ||||||
| 20b | 1.78 (1H, m) | |||||||
| 21 | 2.42 (1H, dt, 11.1/9.0) | 52.0(叔) | C-17, 18, 20, 22, 29, 30 | H-17, 20 | H-29, 30 | |||
| 22 | / | 72.9(季) | ||||||
| 23 | 1.28 (3H, s) | 29.2(伯) | C-3, 4, 5, 24 | H-3, 5 | 0.98 | |||
| 24 | 1.08 (3H, s) | 16.8(伯) | C-3, 4, 5, 23 | 0.77 | ||||
| 25 | 0.90 (3H, s) | 16.6(伯) | C-1, 5, 9, 10 | H-2, 11b | 0.82 | |||
| 26 | 1.01 (3H, s) | 17.3(伯) | C-7, 8, 9, 14 | 0.96 | ||||
| 27 | 1.02 (3H, s) | 17.7(伯) | C-8, 13, 14, 15 | 0.94 | ||||
| 28 | 0.97 (3H, s) | 17.0(伯) | C-13, 17, 18, 19 | 0.77 | ||||
| 29 | 1.40 (3H, s) | 30.3(伯) | C-21, 22, 30 | H-16a, 21 | 1.20 | |||
| 30 | 1.45 (3H, s) | 31.9(伯) | C-21, 22, 29 | H-16a, 21 | 1.20 | |||
| 3-OH | 5.75 (1H, d, 5.3) | / | C-2, 3, 4 | H-3 | ||||
| 22-OH | 4.94 (1H, s) | / | C-21, 22, 29, 30 | |||||
注1:除8个甲基、两个羟基和H-1、H-3、H-5、H-16、H-21外,其余质子的化学位移均通过HSQC读出. 注2:表中仅标注了8个甲基、两个羟基和H-1、H-3、H-5、H-16、H-21的HMBC、1H-1H COSY、NOESY相关信号.
2.2.2 化合物1的归属
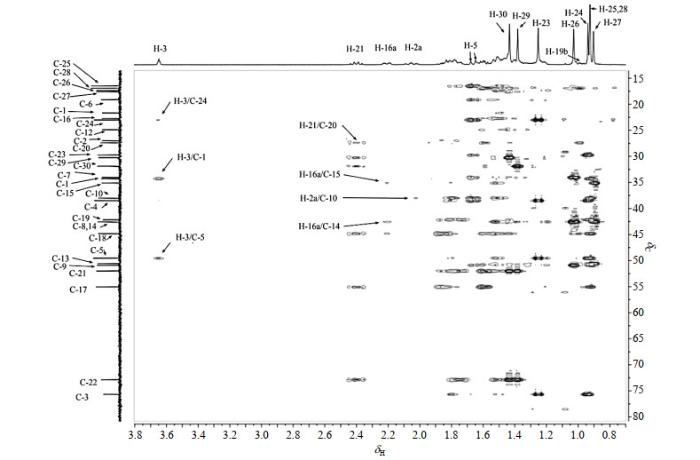
化合物1的1H NMR谱(图S7)中能够直接辨认的信号有8个甲基,δH 2.05(1H,m)、δH 2.21(1H,ddt,J=12.9/4.5/2.4 Hz)、δH 2.40(1H,dt,J=11.1/8.9 Hz)和δH 3.65(1H,t,J=2.8 Hz),根据化学位移可归属δH 3.65(1H,t,J=2.8 Hz)为H-3,但1H NMR谱中未见到3-OH和22-OH的信号,应与δH 4.95处的水峰重叠导致无法辨认.13C NMR谱(图S8)显示化合物有30个碳,DEPT谱(图S9)表明化合物2有8个伯碳,10个仲碳,6个叔碳和6个季碳.1H-1H COSY谱(图S10)中,H-3和δH 2.05(1H,m)、δH 1.81(1H,m)偶合相关,归属δH 2.05(1H,m)和δH 1.81(1H,m)为H-2,结合HSQC谱(图S11)归属δH 75.7(叔)和δH 27.0(仲)为C-3和C-2.由HMBC谱图(图 6)可知,H-3和δC 23.0(伯)、δC 34.3(仲)、δC 49.5(叔)远程偶合相关,结合HSQC谱图,C-1 [δC 34.3(仲)]、C-5 [δC 49.5(叔)]和H-1、H-5得到归属.在HMBC谱中,H-5与δC 16.5(伯)、19.1(仲)、23.0(伯)、29.8(伯)、34.1(仲)、38.0(季)、38.5(季)、50.9(叔)远程偶合相关,δH 1.25(3H,s)与δC 23.0(伯)、38.5(季)、C-5、C-3远程偶合相关,δH 0.94(3H,s)和δC 29.8(伯)、38.5(季)、C-5、C-3远程偶合相关,H-2和δC 38.0(季)远程偶合相关,NOESY谱(图S12)中,H-2和δH 0.93(3H,s)、δH 0.94(3H,s)有相关信号,根据上述信息,H-25 [δH 0.93(3H,s)]、H-24 [δH 0.94(3H,s)]、H-23 [δH 1.25(3H,s)]、C-25 [δC 16.5(伯)]、C-24 [δC 23.0(伯)]、C-23 [δC 29.8(伯)]、C-10 [δC 38.0(季)]、C-4[δC 38.5(季)]、C-9 [δC 50.9(叔)]得到准确归属,结合HSQC可准确归属H-9 [δH 1.47(1H,m)].至此,A环的所有碳原子和质子信号归属完毕.
图6
13C NMR谱中,C-3和δC 72.7(季)处于最低场,归属δC 72.7(季)为C-22.HMBC谱中,δH 2.40(1H,dt,J=11.1/8.9 Hz)与C-22远程偶合相关,结合HSQC谱,可将δH 2.40(1H,dt,J=11.1/8.9 Hz)和δC 52.0(叔)归属为H-21和C-21.而借助于H-21和δC 27.4(仲)、δC 44.8(季)、δC 55.1(叔)在HMBC谱中的远程偶合相关信号,H-21与δH 1.53(1H,m)、δH 1.69-1.89(2H,m)在1H-1H COSY谱中的偶合相关信号,以及HSQC谱图,可归属C-17[δC 55.1(叔)]、C-18 [δC 44.8(季)]、C-20 [δC 27.4(仲)]、H-17 [δH 1.53(1H,m)]和H-20 [δH 1.83(1H,m),δH 1.78(1H,m)].此外,HMBC谱显示,H-21还与δC 30.3(伯)和δC 31.9(伯)远程偶合相关,结合HSQC,可归属H-29 [δH 1.38(3H,s)]、H-30 [δH 1.43(3H,s)]、C-29 [δC 30.3(伯)]和C-30 [δC 31.9(伯)].但由于C21-C22可以自由旋转,借助于HMBC或者NOESY谱图(图S12)均无法确定H-29(C-29)和H-30(C-30)的准确位移,亦即这两组数据可以互换.基于HMBC谱中δH 0.93(3H,s)与C-17和C-18的远程相关信号,将其归属为甲基质子H-28,结合HSQC谱图,可指认C-28 [δC 16.9(伯)].H-28和δC 50.6(叔)、δC 42.2(仲)在HMBC谱中远程偶合相关,结合HSQC谱图,可准确归属C-13[δC 50.6(叔)]、C-19[δC 42.2(仲)]、H-13 [δH 1.44(1H,m)]和H-19 [δH 1.60(1H,m)和δH 1.00(1H,m)].E环的所有质子和碳原子信号得到归属.
HMBC谱中,δH 2.21(1H,ddt,J=12.9/4.5/2.4 Hz)与C-18、δC 35.1(仲)、δC 42.6(季)远程偶合相关,HSQC谱中,该质子和δH 1.80(1H,m)与δC 22.7(仲)相关,NOESY谱中,δH 2.21(1H,ddt,J=12.9/4.5/2.4 Hz)与H-29和H-30相关,归属δH 2.21(1H,ddt,J=12.9/4.5/2.4 Hz)和1.80(1H,m)为H-16,δC 22.7(仲)为C-16,δC 35.1(仲)为C-15,δC 42.6(季)为C-14.HMBC谱中,δH 0.90(3H,s)与C-13、C-14、C-15远程偶合相关,归属δH 0.90(3H,s)为H-27.结合HSQC谱,可准确归属C-27、H-15.D环归属完毕.
HMBC谱中,δH 1.03(3H,s)与C-9、C-14、δC 34.1(仲)、δC 42.6(季)远程偶合相关,H-5与δC 19.1(仲)、δC 34.0(仲)远程偶合相关,归属δH 1.03(3H,s)为H-26,δC 19.1(仲)为C-6,δC 34.1(仲)为C-7,δC 42.6(季)为C-8.结合HSQC谱可归属C-26、H-6和H-7.值得注意的是,C-8和C-14相差仅0.02 ppm,利用HMBC谱中H-16和C-14的远程偶合相关信号可确认C-14位于较低场.B环归属完毕.此时仅余H-11(C-11)和H-12(C-12)未归属,但由于结构中没有仅与C-11或者C-12远程相关的质子,NOESY谱中这两组质子未见与H-25、H-26、H-27、H-28的相关信号,无法准确归属,借助于化合物2中H-11(C-11)和H-12(C-12)的位移,归属δH 1.62(1H,m)和δH 1.35(1H,m)为H-11,δH 1.44(2H,m)为H-12,δC 21.7(仲)为C-11,δC 24.9(仲)为C-12.所有信号归属完毕.HMBC和NOESY谱中主要相关信号如图 7所示.
图7
图7
化合物1中主要的1H-13C远程偶合相关(→)和1H-1H NOE相关(↔)
Fig.7
Selected key 1H-13C heteronuclear multiple-bond connectivity (→) and 1H-1H NOESY correlations (↔) of compound 1
化合物1的所有1H NMR和13C NMR数据如表 3所示.
表3 化合物1的1H和13C NMR实验数据(溶剂:Pyridine-d5)和文献数据(溶剂:CDCl3)
Table 3
| No. | 实验 | 文献[2] CDCl3 | ||||||
| δH (J/Hz) | δC | HMBC | 1H-1H COSY | NOESY | δH (J/Hz) | δC | ||
| 1a | 1.78 (1H, m) | 34.3(仲) | 33.2 | |||||
| 1b | 1.49 (1H, m) | |||||||
| 2a | 2.05 (1H, m) | 27.0(仲) | C-10 | H-2b, 3 | H-25 | 25.3 | ||
| 2b | 1.81 (1H, m) | H-2a, 3 | ||||||
| 3 | 3.65 (1H, t, 2.8) | 75.7(叔) | C-1, 5, 24 | H-2 | H-23, 24 | 3.39 (1H, t, 3.1) | 76.2 | |
| 4 | / | 38.5(季) | 37.5 | |||||
| 5 | 1.66 (1H, dd, 11.9/1.5) | 49.5(叔) | C-4, 6, 7, 9, 10, 23, 24, 25 | H-23 | 48.8 | |||
| 6a | 1.51 (1H, m) | 19.1(仲) | 18.3 | |||||
| 6b | 1.43 (1H, m) | |||||||
| 7a | 1.53 (1H, m) | 34.1(仲) | 33.2 | |||||
| 7b | 1.21 (1H, m) | |||||||
| 8 | / | 42.558(季) | 41.8 | |||||
| 9 | 1.47 (1H, m) | 50.9(叔) | 50.0 | |||||
| 10 | / | 38.0(季) | 37.2 | |||||
| 11a | 1.62 (1H, m) | 21.7(仲) | 20.9 | |||||
| 11b | 1.35 (1H, m) | |||||||
| 12 | 1.44 (2H, m) | 24.9(仲) | 24.1 | |||||
| 13 | 1.44 (1H, m) | 50.6(叔) | 49.9 | |||||
| 14 | / | 42.575(季) | 41.9 | |||||
| 15a | 1.40 (1H, m) | 35.1(仲) | 34.7 | |||||
| 15b | 1.23 (1H, m) | |||||||
| 16a | 2.21(1H, ddt, 12.9/4.5/2.4) | 22.7(仲) | C-14, 15, 18 | H-15, 16b | H-29, 30 | 21.9 | ||
| 16b | 1.80 (1H, m) | H-15, 16a | ||||||
| 17 | 1.53 (1H, m) | 55.1(叔) | 53.9 | |||||
| 18 | / | 44.8(季) | 44.1 | |||||
| 19a | 1.60 (1H, m) | 42.2(仲) | 41.3 | |||||
| 19b | 1.00 (1H, m) | |||||||
| 20a | 1.83 (1H, m) | 27.4(仲) | 26.6 | |||||
| 20b | 1.78 (1H, m) | |||||||
| 21 | 2.40 (1H, dt, 11.1/8.9) | 52.0(叔) | C-17, 18, 20, 22, 29, 30 | H-17, 20 | H-29, 30 | 51.1 | ||
| 22 | / | 72.7(季) | 73.9 | |||||
| 23 | 1.25 (3H, s) | 29.8(伯) | C-3, 4, 5, 24 | H-3, 5 | 0.76 | 28.3 | ||
| 24 | 0.94 (3H, s) | 23.0(伯) | C-3, 4, 5, 23 | H-3 | 0.94 | 22.1 | ||
| 25 | 0.93 (3H, s) | 16.5(伯) | C-1, 5, 9, 10 | H-2a | 0.83 | 15.7 | ||
| 26 | 1.03 (3H, s) | 17.4(伯) | C-7, 8, 9, 14 | 0.96 | 17.0 | |||
| 27 | 0.90 (3H, s) | 17.6(伯) | C-8, 13, 14, 15 | 0.96 | 17.1 | |||
| 28 | 0.93 (3H, s) | 16.9(伯) | C-13, 17, 18, 19 | 0.76 | 16.2 | |||
| 29 | 1.38 (3H, s) | 30.3(伯) | C-21, 22, 30 | H-16a, 21 | 1.18 | 28.7 | ||
| 30 | 1.43 (3H, s) | 31.9(伯) | C-21, 22, 29 | H-16a, 21 | 1.21 | 30.9 | ||
| 3-OH | / | / | ||||||
| 22-OH | / | / | ||||||
注1:除8个甲基、两个羟基和H-2、H-3、H-5、H-16、H-21外,其余质子的化学位移均通过HSQC读出;注2:表中仅标注了8个甲基、两个羟基和H-2、H-3、H-5、H-16、H-21的HMBC、1H-1H COSY、NOESY相关信号.
2.3 化合物1和化合物2的差异
化合物1和化合物2构型不同除了影响氢核和碳核的化学位移之外,两者的1H-13C远程偶合相关也有差别.最明显的是化合物1的H-3和C-1、C-5、C-24远程偶合相关,而化合物2的H-3与C-4、C-23、C-24远程偶合相关.HMBC谱中氢核和碳核的多键偶合常数(nJH, C)通常选择8 Hz,这个数值能够满足绝大部分的两键(2JH, C)或者三键(3JH, C)的碳氢偶合常数.而化合物1和化合物2的H-3所处位置不同,导致与H-3的偶合常数为8 Hz(nJH, C=8 Hz)的碳原子也不相同.
3 结论
本文通过XRD实验确定了3β, 22-二羟基何伯烷(2)的绝对构型,在此基础上,完整归属和确认了3α, 22-二羟基何伯烷(1)和3β, 22-二羟基何伯烷(2)的1H和13C NMR数据.此外,通过保护羟基来分离单一构型的化合物1和化合物2这两种异构体的方法也同样适用于其他各种难以分离的α-和β-异构体.
参考文献
Triterpenoids from ten Lithocarpus species of HongKong
[J].DOI:10.1016/0031-9422(75)85187-9 [本文引用: 2]
Saturated hopane and gammacerane triterpene-diols from the stem bark of Abies Veitchii
[J].DOI:10.1016/0031-9422(92)83723-C [本文引用: 6]
Six new triterpenoids and other triterpenoids and steroids from three Quercus species of HongKong
[J].
3β, 22-dihydroxyhopane and other constituents from the leaves of Castanopsis Eyrei Tutch. of HongKong
[J].DOI:10.1071/CH9682583 [本文引用: 2]
Saturated gammaceranes from the stem bark of Abies MariesII
[J].DOI:10.1021/np50108a012 [本文引用: 1]
Structures of eight new triterpenoids and isolation of other triterpenoids and epi-ikshusterol from the stems of Lithocarpus cornea
[J].
Über ein neues triterpen aus Dammar-Harz
[J].DOI:10.1002/cber.19630961126 [本文引用: 1]
Squalene-hopene cyclase: final deprotonation reaction, conformational analysis for the cyclization of (3R, S)-2, 3-oxidosqualene and further evidence for the requirement of an isopropylidene moiety both for initiation of the polycyclization cascade and for the formation of the 5-membered E-ring
[J].DOI:10.1039/B401172D [本文引用: 6]
Novel betulinic acid-nucleoside hybrids with potent anti-HIV activity
[J].DOI:10.1021/acsmedchemlett.0c00414 [本文引用: 1]
Synthesis of new 2'-deoxy-2'-fluoro-4'-azido nucleoside analogues as potent anti-HIV agents
[J].DOI:10.1016/j.ejmech.2011.06.020 [本文引用: 1]
Functional analysis of the DXDDTA motif in squalene-hopene cyclase by site-directed mutagenesis experiments: initiation site of the polycyclization reaction and stabilization site of the carbocation intermediate of the initially cyclized a-ring
[J].DOI:10.1271/bbb.63.2189 [本文引用: 1]